微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)配平并完成下面离子方程式:
?HCl + ?KClO3=?Cl2 + ?KCl+ ?[? ]
参考答案:6;1;3;1;3 ;H2O 每空1分
本题解析:考查氧化还原反应方程式的配平。在氧化还原反应中电子的得失必须是守恒的,据此进行配平。在反应中HCl中氯元素的化合价由-1价升高到0价,变化1个单位。氯酸钾中氯元素的化合价由+5价降低到0价,变化5个单位。属于还原剂和氧化剂的物质的量之比是5︰1。又因为生成物氯化钾中的氯原子来自于氯化氢中的,根据原子守恒可知,另一种生成物是水,所以反应式为6HCl + KClO3=3Cl2 + KCl+3H2O。
本题难度:一般
2、选择题 以下为在浓盐酸中H3AsO3与SnCl2反应的离子方程式,关于该反应的说法正确的组合是:(? )?
a SnCl2+b Cl-+c H3AsO3+d H+=e As+f SnCl62-+g M?
①氧化剂是H3AsO3;?②M为OH-;
③每生成7.5gAs,还原剂失去的电子为0.3?mol;?④ SnCl62-是氧化产物。
A.①③④
B.①②④
C.①②③④
D.只有①③
参考答案:A
本题解析:Sn元素由+2价升至+4价,SnCl62-是氧化产物,而As元素由+3价降至0价,氧化剂是H3AsO3;
由化合价的升降守恒得:3SnCl2+b Cl-+2H3AsO3+d H+=2As+3SnCl62-+g M,再由由电荷守恒及原子守恒可得:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6H2O
故每生成7.5gAs,还原剂SnCl2失去的电子为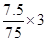 =0.3mol
=0.3mol
由于溶液为强酸性溶液,M不可能为OH—,排除②
答案为A
本题难度:一般
3、选择题 对于氧化还原反应8Fe(NO3)2+10HNO3=8Fe(NO3)3+NH4NO3+3H2O,以下叙述错误的是?(?)
A.还原产物为NH4NO3
B.氧化剂与还原剂的物质的量之比为8:1
C.若有1 mol NO3-参加还原反应,则转移8mol电子
D.若应用该反应设计原电池,原电池的负极反应可表示为Fe2+-e-=Fe3+
参考答案:B
本题解析:略
本题难度:简单
4、选择题 在含有n克HNO3的稀溶液中,恰好将5.6克铁粉完全溶解,若有n/4克HNO3被还原成NO(无其它还原产物),则n值不可能是(?)
A.12.6克
B.16.8克
C.18.9克
D.25.2克
参考答案:A
本题解析:铁与硝酸反应有两种情况,如果铁过量则生成硝酸亚铁,如果铁少量则生成硝酸铁,根据反应方程式3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O、Fe+4HNO3=Fe(NO3)3+NO↑+2H2O可以看出不管生成硝酸亚铁还是生成硝酸铁,被还原的硝酸都是硝酸总量的1/4。所以5.6克铁粉完全溶解,需要硝酸的最大量为25.2g,最小量为16.8,因此n值不可能为12.6g。答案选A。
点评:本题用极限法来解题。
本题难度:一般
5、选择题 常温常压下过氧化钠可与CO2反应,与CO不反应。现将CO2、CO的混合气体在一定条件下和足量过氧化钠充分反应后,若固体质量增加了28 g,下列说法正确的是
A.反应过程中,电子转移数为2NA
B.固体生成物的质量为106 g
C.CO可能有剩余
D.反应后一定生成11.2 L氧气
参考答案:B
本题解析:2CO2+2Na2O2=2Na2CO3+O2 Δm
88 g?56 g
x?28 g
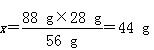
所以1 mol Na2O2反应,转移电子数为NA,固体生成物的质量为106 g,CO不参与反应,一定剩余,反应后在标准状况下生成11.2 L O2。
本题难度:一般