微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知2Fe2++Br2=2Fe3++2Br-。向100mL的FeBr2溶液中通入标准状况下的Cl2 3.36L,充分反应后测得溶液中Cl-与Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为
A.2 mol/L
B.1 mol/L
C.0.4 mol/L
D.0.2 mol/L
参考答案:A
本题解析:还原性Fe2+>Br-,所以通入氯气先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再反应反应2Br-+Cl2═Br2+2Cl-,溶液中含有Br-,说明氯气完全反应,Cl2的物质的量为3.36L÷22.4L/mol=0.15mol,若Br-没有反应,则c(FeBr2)=0.5n(Br-)=0.15mol,0.15molFe2+只能消耗0.075mol的Cl2,故有部分Br-参加反应;
设FeBr2的物质的量为x,则n(Fe2+)="x" mol,n(Br-)="2x" mol,未反应的n(Br-)="0.3" mol,参加反应的n(Br-)=(2x-0.3)mol,根据电子转移守恒有x×1+[2x-0.3]×1=0.15mol×2,解得x="0.2" mol,所以原FeBr2溶液的物质的量浓度为0.2mol÷0.1L=2mol/L.
故选A。
点评:考查反应方程式的计算,难度中等,清楚还原性Fe2+>Br-,通入的Cl2首先氧化Fe2+,待Fe2+全部被氧化后才氧化Br-,判断Br-是否完全反应,是解题的关键。
本题难度:简单
2、选择题 现取m g镁铝合金在一定浓度的稀硝酸中恰好完全溶解(硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol·L-1 NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中正确的有( )。
①沉淀中OH-的质量为(n-m)g
②恰好溶解后溶液中的NO3—的物质的量为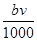 ?mol
?mol
③反应过程中转移的电子数为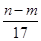 ?mol
?mol
④标准状况下生成NO的体积为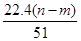 L
L
⑤与合金反应的硝酸的物质的量为(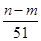 +
+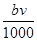 )mol
)mol
A.5项
B.4项
C.3项
D.2项
参考答案:A
本题解析:本题涉及的反应有Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O;3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O;Al(NO3)3+3NaOH=Al(OH)3↓+3NaNO3;Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3。当合金恰好溶解时,溶液中的NO3—与Na+的物质的量相等,n(NO3—)=n(NaOH)=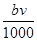 ?mol,故②正确。沉淀质量最大时,生成的n g沉淀为氢氧化铝和氢氧化镁,根据质量守恒定律,其中镁、铝元素的质量等于m g,所以沉淀中氢氧根的质量为(n-m)g,则反应过程中转移的电子物质的量n(e-)=n(OH-)=
?mol,故②正确。沉淀质量最大时,生成的n g沉淀为氢氧化铝和氢氧化镁,根据质量守恒定律,其中镁、铝元素的质量等于m g,所以沉淀中氢氧根的质量为(n-m)g,则反应过程中转移的电子物质的量n(e-)=n(OH-)=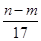 mol,故①,③正确。根据电子得失守恒知,标准状况下V(NO)=
mol,故①,③正确。根据电子得失守恒知,标准状况下V(NO)=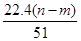 ?L,故④正确。参加反应的硝酸有两种作用,起酸性作用的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,即
?L,故④正确。参加反应的硝酸有两种作用,起酸性作用的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,即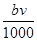 ?mol;作氧化剂的硝酸的物质的量等于NO的物质的量,即
?mol;作氧化剂的硝酸的物质的量等于NO的物质的量,即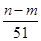 ?mol,所以,与合金反应的硝酸的物质的量为(
?mol,所以,与合金反应的硝酸的物质的量为(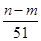 +
+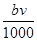 )mol,故⑤正确。
)mol,故⑤正确。
本题难度:一般
3、选择题 用高铁酸钠(Na2FeO4)对水消毒是城市饮用水处理的新技术。已知反应:Fe2O3+3Na2O2=2Na2FeO4+Na2O,下列说法正确的是
A.Na2O2既是氧化剂又是还原剂
B.Na2FeO4既是氧化产物又是还原产物
C.3 mol Na2O2发生反应,有12 mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
参考答案:B
本题解析:对题目中的反应方程式作分析可知:Na2O2作氧化剂,氧元素由-1价降低到-2价,A错。铁元素由Fe2O3中的+3价升高到Na2FeO4中的+6价,Na2FeO4既是氧化产物又是还原产物,B正确,D错。C中3 mol Na2O2发生反应,有6 mol电子转移。答案选B。
本题难度:一般
4、简答题 已知在稀硫酸中,KBrO3和KI能发生以下反应(均未配平):
BrO3-+H++I-→I03-+Br2+H20?I03-+H++Br-→Br2+I2+H20
(1)试比较在酸性条件下BrO3-、Br2、I03-、I2氧化性的强弱:______>______>______>______.
(2)配平下列反应的离子方程式:
______BrO3-+______H++______I-→______I2+______Br-+______H20
反应中的氧化剂是______;被氧化的元素是______.
(3)在稀硫酸中,若KI和KBrO3按物质的量之比6:1.1反应,生成的产物是H20、______、______、
______?(用化学式或离子符号表示).
参考答案:(1)在反应BrO3-+H++I-→I03-+Br2+H20中,氧化性:BrO3->I03-,在反应I03-+H++Br-→Br2+I2+H20中,
氧化性:I03->Br2,又氧化性:Br2>I2,则氧化性:BrO3->I03->Br2>I2,故答案为:BrO3->I03->Br2>I2;
(2)反应中BrO3-化合价由+5价降为-1价,I-化合价由-1价升高为0价,二者在反应中得失电子数目相等,则有二者的计量数比值为1:6,根据离子方程式电荷守恒,可配平衡方程式为6I-+BrO3-+6H+=3I2+Br-+3H20,其中氧化剂为BrO3-,还原剂为I-,故答案为:1,6,6,3,1,3;BrO3-;I-;
(3)I的价态有-1,0,+5,+7,Br的价态也是-1,0,+5,+7,KI和KBrO3按物质的量之比6:1.1反应若I-被氧化成+5或是+7价,那么按照参加反应的KI和KBrO3按物质的量之比6:1.1,是绝对不可能的,所以I-只能被氧化成0价,即I2,6molI-被氧化成I2失去6mol电子,Br最后只可能被还原成0价,或是-1价,若为0价,则1.1molKBrO3得电子5.5mol,若为-1价,则1.1molKBrO3得电子6.6mol,6mol正好在5.5和6.6之间,说明KBrO3被还原为两种价态:0和-1,即为Br2和Br-.故答案为:I2;Br2;Br-;.
本题解析:
本题难度:一般
5、选择题 a mol FeS与b mol FeO投入到VLc mol/L稀硝酸中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63g?②(a+b)×189g?③(a+b)mol?④(cV-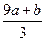 )mol
)mol
A.①④
B.②④
C.②③
D.①③
参考答案:B
本题解析:略
本题难度:一般