微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 硫酸铵在强热条件下分解生成氨气、二氧化硫、氮气和水 3(NH4)2SO4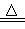 4NH3↑+3SO2↑+N2↑+6H2O,反应中生成的氧化产物和还原产物的物质的量之比是
4NH3↑+3SO2↑+N2↑+6H2O,反应中生成的氧化产物和还原产物的物质的量之比是
A.1∶3
B.2∶3
C.1∶1
D.4∶3
参考答案:A
本题解析:N2是氧化产物,SO2是还原产物,物质的量之比是1:3,故选A。
点评:本题题考查的是氧化还原反应,明确还原剂、氧化剂中元素的化合价变化是解答本题的关键。
本题难度:一般
2、选择题 一定质量的某铁的氧化物FexOy,与足量4 mol/L稀硝酸溶液充分反应,消耗硝酸700 mL,放出2.24 L NO气体(标准状况)。则该铁的氧化物的化学式为( )
A.FeO
B.Fe2O3
C.Fe3O4
D.Fe8O10
参考答案:C
本题解析:参加反应的硝酸分氧化剂和酸两部分,其物质的量比为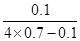 ,1 mol FexOy与足量稀硝酸反应,起酸作用的硝酸为3x mol,起氧化剂作用的硝酸为
,1 mol FexOy与足量稀硝酸反应,起酸作用的硝酸为3x mol,起氧化剂作用的硝酸为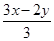 ,故
,故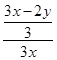 =
=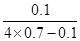 ,解得x/y=3/4
,解得x/y=3/4
本题难度:一般
3、选择题 已知K2O、K2O2、KO2的名称依次是氧化钾、过氧化钾、超氧化钾。那么BaO2的名称是( )
A.氧化钡
B.过氧化钡
C.超氧化钡
D.无法确定
参考答案:B
本题解析:因钾只有+1价,故K2O、K2O2、KO2中的阴离子分别为O2—、O22—、O2—,BaO2中钡为+2价,阴离子为O22—。将K2O2中的K22+代换为Ba2+即得BaO2,那么BaO2的名称应为过氧化钡。
本题难度:简单
4、填空题 金属钼(Mo)可以增强合金的某些机械性能和耐腐蚀性。下图是化工生产中制备金属铝的实验流程图(已知铝酸为难溶于水和酸的黄色晶体):

(1)在灼烧铝矿时发生化学反应: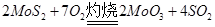 ,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
(2)步骤①中,灼烧钼矿时,用于盛放固体的仪器的名称为________。
(3)写出步骤②中发生反应的离子方程式_________________________________。
(4)在步骤③中需要加入过量硝酸,检验硝酸过量的操作为_________________。
(5)某同学拟选用如下装置,用氢气还原三氧化铝,同时检验该反应的氧化产物,根据要求回答下列问题。
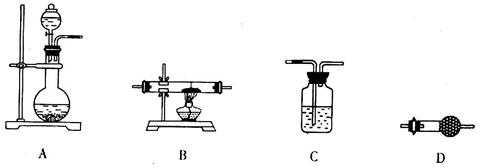
①若两次使用到C装置,则装置D中所盛的药品是________(填试剂名称)。
②根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞后______→______→______→______(请按正确的顺序填入下列步骤的代号)。
a.收集气体并检验其纯度? b.停止加热,充分冷却
c.加热反应一段时间? d.关闭分液漏斗活塞,停止通氢气
参考答案:(1)MoS2(1分)? 14mol(2分)
(2)坩埚(1分)
(3)2NH3·H2o+MoO3=2NH4++ MoO42-+H2O(2分)
(4)静置后,向上层清液中继续滴加硝酸,若无明显现象,则硝酸过量。(2分)
(5)①无水硫酸铜(2分)
②a→c→b→d(2分)
本题解析:(1)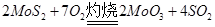 ,MoS2化合价升高为还原剂。1mol MoS2反应时,+4价Mo被氧化成+6价,-2价S被氧化成+4价 S,则失电子为14mol。
,MoS2化合价升高为还原剂。1mol MoS2反应时,+4价Mo被氧化成+6价,-2价S被氧化成+4价 S,则失电子为14mol。
(2)步骤①中,灼烧使用的一起为坩埚。
(3)(4)见答案
(5)①该反应的氧化产物为水,用无水硫酸铜检验。
②见答案
本题难度:一般
5、选择题 一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和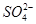 )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
A.9.0 L
B.13.5 L
C.15.7 L
D.16.8 L
参考答案:A
本题解析:若混合物全是CuS,其物质的量为12/80=0.15 mol,电子转移数0.15 mol×(6+2)=1.2 mol。两者体积相等,设NO x mol,NO2 x mol,3x+x=1.2,计算的x=0.3。气体体积V=0.6 mol×22.4 L·mol-1=13.44 L;若混合物全是Cu2S,其物质的量为0.075 mol,转移电子数0.075 mol×10=0.75 mol,设NO x mol,NO2 x mol,3x+x=0.75,计算得x=0.187 5,气体体积V=0.375 mol×22.4 L·mol-1=8.4 L,因此8.4 L<V<13.44 L。
本题难度:一般