| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《反应速率与平衡的有关计算》考点巩固(2017年最新版)(九)
Ⅱ.研究NO2 ?、SO2 、CO等大气污染气体的处理具有重要意义。其中氮元素有着多变价态和种类多的化合物,它们在工农业生产、生活中发挥着重要的作用。完成下列问题: (1)已知:2SO2(g) + O2(g)  2SO3(g)? ΔH=" —196.6" kJ·mol―1 2SO3(g)? ΔH=" —196.6" kJ·mol―12NO(g) + O2(g)  2NO2(g)? ΔH= —113.0 kJ·mol―1 2NO2(g)? ΔH= —113.0 kJ·mol―1则反应NO2(g) + SO2(g)  SO3(g) + NO(g) 的ΔH= ??。 SO3(g) + NO(g) 的ΔH= ??。(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应, ①下列能说明反应达到平衡状态的是?(填序号) 。 a.体系压强保持不变? b.混合气体颜色保持不变 c.SO3和NO的体积比保持不变? d.相同时间内,每消耗1 molNO2的同时消耗1 mol SO3 ②当测得上述反应平衡时NO2与SO2体积比为1: 6,则平衡常数K=?。 2、填空题 (11分) |
3、填空题 将1molCO和1molH2O充入某固定容积的反应器中,在某条件下达到平衡:
CO+H2O(g)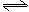 CO2+H2,此时有2/3的CO转化为CO2。
CO2+H2,此时有2/3的CO转化为CO2。
(1)该平衡混合物中CO2的体积分数为??
(2)若容器体积为1L,到达平衡所需时间为2分钟,则H2的平均反应速率为??
(3)若在相同条件下,向容器中充入1molCO2、1molH2和1molH2O,则达到平衡时与⑴中平衡相比较,平衡应向?(填“正反应方向”、“逆反应方向”或“不”)移动,此时平衡混合物中CO2的体积分数可能是下列各值中的??
A.22.2%
B.27.55%
C.33.3%
D.36.8%
(4)结合(3)中计算结果分析若平衡向正方向移动时,则下列说法中正确的是(?)
①生成物的产量一定增加;?②生成物的体积分数一定增加;
③反应物的转化率一定增大; ?④反应物的浓度一定降低;
⑤正反应速率一定大于逆反应速率;?⑥一定使用了催化剂.
4、填空题 Ⅰ.恒温恒压下,在一体积可变的密闭容器中发生下列反应:4AC(g)+2BC2(g) 4AC2(g)+B2(g),在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是_______(用含a的代数式表示);
4AC2(g)+B2(g),在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是_______(用含a的代数式表示);
Ⅱ.若维持温度不变,在一个与Ⅰ反应前的起始体积相同容积固定的密闭容器中发生Ⅰ中所述的化学反应,开始时仍向容器中充入AC和BC2各1 mol,达平衡时生成AC2和B2共b mol,将b与Ⅰ中的a进行比较,则a_______b (填“>”“<”“=”或“不能确定”)
5、选择题 用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A.加热
B.加入硝酸钠固体
C.滴加少量CuSO4溶液
D.不用铁片,改用铁屑
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《中和滴定实.. | |