| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《反应速率与平衡的有关计算》考点巩固(2017年最新版)(十)
Ⅱ.研究NO2 ?、SO2 、CO等大气污染气体的处理具有重要意义。其中氮元素有着多变价态和种类多的化合物,它们在工农业生产、生活中发挥着重要的作用。完成下列问题: (1)已知:2SO2(g) + O2(g)  2SO3(g)? ΔH=" —196.6" kJ·mol―1 2SO3(g)? ΔH=" —196.6" kJ·mol―12NO(g) + O2(g)  2NO2(g)? ΔH= —113.0 kJ·mol―1 2NO2(g)? ΔH= —113.0 kJ·mol―1则反应NO2(g) + SO2(g)  SO3(g) + NO(g) 的ΔH= ??。 SO3(g) + NO(g) 的ΔH= ??。(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应, ①下列能说明反应达到平衡状态的是?(填序号) 。 a.体系压强保持不变? b.混合气体颜色保持不变 c.SO3和NO的体积比保持不变? d.相同时间内,每消耗1 molNO2的同时消耗1 mol SO3 ②当测得上述反应平衡时NO2与SO2体积比为1: 6,则平衡常数K=?。 参考答案: 理科综合试卷·第1页(共16页)  ?CH3OH + H2O(2分)② 0.225 (1分)? ③ 75%?(1分)? < (1分)? ④ C(1分) ?CH3OH + H2O(2分)② 0.225 (1分)? ③ 75%?(1分)? < (1分)? ④ C(1分)(2)CH3OH-6 e- + 8OH- =CO32-?+?6H2O(2分) II.(1)-41.8 kJ·mol-1(2分)(2)①b d(2分)?②8/3或2.67(2分) 本题解析:I.(1)① 根据反应物和生成物可知,方程式为 CO2 + 3H2 本题难度:一般 2、填空题 (11分) |
参考答案:(1)?减小(1分)?(2)增大?增大?(2分)
(3)升高温度?减小压强?增大反应物浓度?使用了催化剂?(4分)
(Ⅱ)(1)(2)
本题解析:(Ⅰ)(1)反应是放热反应,所以升高温度平衡向逆反应方向移动,平衡常数减小。
(2)增大生成物浓度,正逆反应速率都是增大的。
(3)t2时正逆反应速率都是增大的,但平衡向逆反应方向移动,所以改变的条件是升高温度。t4时正逆反应速率都是减小的,但平衡向逆反应方向移动,所以改变的条件是减小压强;t6时正反应速率增大,逆反应速率不变,平衡向正反应方向移动,所以改变的条件是增大反应物浓度;t8时,正逆反应速率都是增大的,但平衡不移动,所以改变的条件是使用了催化剂,
(Ⅱ)(1)根据平衡常数的表达式可知,方程式为C+H2O(g) H2+CO。
H2+CO。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以B正确。E中反应速率的方向是相同的,不正确。反应前后条件减小,所以压强也是减小的,D正确。密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但质量是变化的,所以C正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量和物质的量都是变化的,所以A可以说明。答案选ABCD。
本题难度:一般
3、填空题 将1molCO和1molH2O充入某固定容积的反应器中,在某条件下达到平衡:
CO+H2O(g)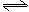 CO2+H2,此时有2/3的CO转化为CO2。
CO2+H2,此时有2/3的CO转化为CO2。
(1)该平衡混合物中CO2的体积分数为??
(2)若容器体积为1L,到达平衡所需时间为2分钟,则H2的平均反应速率为??
(3)若在相同条件下,向容器中充入1molCO2、1molH2和1molH2O,则达到平衡时与⑴中平衡相比较,平衡应向?(填“正反应方向”、“逆反应方向”或“不”)移动,此时平衡混合物中CO2的体积分数可能是下列各值中的??
A.22.2%
B.27.55%
C.33.3%
D.36.8%
(4)结合(3)中计算结果分析若平衡向正方向移动时,则下列说法中正确的是(?)
①生成物的产量一定增加;?②生成物的体积分数一定增加;
③反应物的转化率一定增大; ?④反应物的浓度一定降低;
⑤正反应速率一定大于逆反应速率;?⑥一定使用了催化剂.
参考答案:(1)33.3%;(2分)
(2) ?mol/L/min(2分)
?mol/L/min(2分)
(3)正反应方向,(2分)B ;(3分)?
(4)①⑤(3分)
本题解析:略
本题难度:一般
4、填空题 Ⅰ.恒温恒压下,在一体积可变的密闭容器中发生下列反应:4AC(g)+2BC2(g) 4AC2(g)+B2(g),在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是_______(用含a的代数式表示);
4AC2(g)+B2(g),在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是_______(用含a的代数式表示);
Ⅱ.若维持温度不变,在一个与Ⅰ反应前的起始体积相同容积固定的密闭容器中发生Ⅰ中所述的化学反应,开始时仍向容器中充入AC和BC2各1 mol,达平衡时生成AC2和B2共b mol,将b与Ⅰ中的a进行比较,则a_______b (填“>”“<”“=”或“不能确定”)
参考答案:80a%?>?
本题解析:生成的AC2和B2的物质的量之比为4∶1,所以生成的AC2的物质的量为0.8amol,故消耗的AC的物质的量为0.8amol,所以AC的转化率="0.8amol÷1" mol×100%=80a%;由于该反应是体积缩小的反应,Ⅰ中体积可变,压强恒等,Ⅱ中体积不变,压强减小,故对于Ⅰ中而言,相当于增大压强,平衡向体积缩小的方向(正方向)移动,所以a>b。
本题难度:简单
5、选择题 用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A.加热
B.加入硝酸钠固体
C.滴加少量CuSO4溶液
D.不用铁片,改用铁屑
参考答案:B
本题解析:考查外界条件对反应速率的影响。温度越高,浓度越大反应速率越快。反应物的接触面积越大,反应速率越快。滴加少量硫酸铜溶液,铁可以置换出铜,构成原电池加快反应速率。若加入硝酸钠,则在酸性溶液中铁和硝酸反应生成物不是氢气而是NO,所以答案是B。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《中和滴定实.. | |