微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用右图所示装置进行实验,下列对实验现象的解释不合理的是

?
| ①中试剂
| ①中现象
| 解?释
|
A
| Ba(NO3)2溶液
| 生成白色沉淀
| SO32-与Ba2+生成白色BaSO3沉淀
|
B
| 品红溶液
| 溶液褪色
| SO2具有漂白性
|
C
| 紫色石蕊溶液
| 溶液变红
| SO2与水反应生成酸
|
D
| 酸性KMnO4溶液
| 紫色褪去
| SO2具有还原性
|
?
2、选择题 硫和浓氢氧化钠溶液共热至沸,反应后,硫转化为S2-、SO32-,则反应的S和生成的S2-、SO32-的物质的量比为?
A.2∶1∶1
B.3∶2∶1
C.3∶1∶2
D.4∶1∶3
3、实验题 测定生成SO3的转化率可以用下图装置,装置中烧瓶内发生的化学反应方程式为:Na2SO3(s)+H2SO4(85%)=Na2SO4+H2O+SO2↑(已知SO3的熔点是16.8oC,沸点是44.8oC)
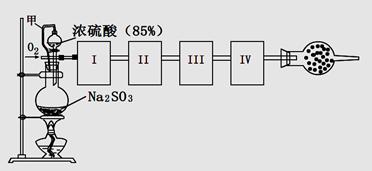
(1)装置中甲管的作用是__________________。
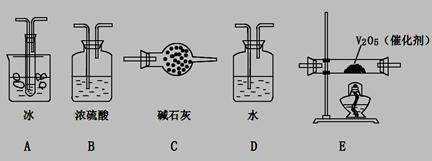
(2)根据实验需要,应该在I、II、III、IV处连接合适的装置,请从下图A?E装置中选择最适合装置并将其序号填至下面的空格中,每个装置不重复使用。
I、 II、III、IV处连接的装置分别是?。
(3)为使SO2有较高的转化率,实验中加热催化剂与滴加浓硫酸的顺序中,应采取的操作是____________ ,若用大火加热烧瓶时,SO2的转化率会____________ (填“升高”、“不变”或“降低”)。
(4)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因(可以不填满)①原因:______? ②原因 :______?③原因:______
(5)将SO2通入含1mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为?
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置IV增重了 mg,则实验中SO2的转化率为?。(用含m、n的代数式填写)
4、填空题 (15分)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一?焦亚硫酸钠的制取
采用右图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
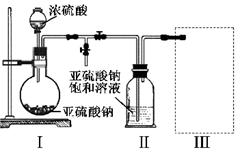
(1)装置I中产生气体的化学方程式为?。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是?。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为?(填序号)。

实验二?焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-?的电离程度大于水解程度,可采用的实验方法是?(填序号)。
a.测定溶液的pH? b.加入Ba(OH)2溶液? c.加入盐酸?
d.加入品红溶液? e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是?。
实验三?葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为?g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果?(填“偏高”“偏低”或“不变”)。
5、实验题 下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白。
(1)如下图将装置中①②③三部分仪器的连接顺序变为②①③,则可以检验出的物质
是___________;不能检验出的物质是___________。
(2)如果将仪器的连接顺序变为①③②,则可以检验出的物质是___________;不能检验出的物质是___________。

(3)如果将仪器的连接顺序变为②③①,则可以检验出的物质是___________;不能检验出的物质是___________。