微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。 下列有关说法中,正确的是
A.N5+ 离子中含有36个电子
B.H2与H3属于同素异形体
C.C60的摩尔质量为720
D.O2与O4属于同位素
参考答案:B
本题解析:A、氮元素为7号元素,核外电子数为7,N5+ 离子中含有34个电子,错误;B、H2与H3都是氢元素形成的单质,属于同素异形体,正确;C、C60的摩尔质量为720g·mol,错误;D、O2与O4是氧元素形成的不同单质,属于同素异形体,错误。
本题难度:一般
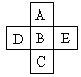
2、填空题 (9分)(Ⅰ)A、B、C、D、E五种元素在周期表里的位置如下表所示:
A、B、C为同主族元素,A为该族中原子半径最小的元素;D、B、E为同周期元素,E为该周期中原子半径最小的元素。D元素名称是 ,在周期表第 周期,第 族,其原子结构示意图 。
(Ⅱ)A、B、C、D、E、F六种短周期元素的原子序数依次增大。已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的符号A ,D ,E 。
(2)A、C两种元素最高价氧化物的水化物之间反应的离子方程式 。
参考答案:(Ⅰ)磷,3,VA,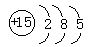 ?(每空1分,共4分)
?(每空1分,共4分)
(Ⅱ)(1)Na;Si;P(每空1分,共3分)
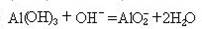 (2分)
(2分)
本题解析:(Ⅰ)A、B、C、D、E五种元素在周期表上下左右紧邻,能符合条件的,必然在元素周期表的右上部,A为第二周期,B、D、E为第三周期;E为该周期中原子半径最小的元素,E为第七主族元素氯,则A为氧,B为硫,C为硒,D为磷。
(Ⅱ)A、C、F三种元素的最高价氧化物的水化物之间两两皆能反应,必然含Na 、Al,根据A、C、F三原子的最外层共有11个电子,结合起来A、Na,C、Al,F、Cl;D元素原子的最外层电子数比次外层电子数少4个,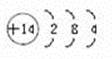 D元素为硅;E元素原子的次外层电子数比最 91EXAM.org外层电子数多3个,
D元素为硅;E元素原子的次外层电子数比最 91EXAM.org外层电子数多3个, ,E元素为磷;
,E元素为磷;
本题难度:一般
3、填空题
已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是?;
(2)B和C的分子式分别是?和?;C分子的立体结构呈?型,该分子属于?分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是?,该反应的化学方程式为?;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是?。
参考答案:答案:(1)1s22s22p63s23p6?(2)HCl? H2S? V?极性?(3)H2O2? 2H2O2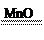 2H2O+O2↑(4)CH4O
2H2O+O2↑(4)CH4O
本题解析:
(1)因A有18个电子且只有1个原子,所以A为18号元素Ar,按照核外电子排布规律可以写出其电子排布式为1s22s22p63s23p6 。
(2)B、C两分子均有2种元素组成的,是分别含有2和3个原子的18电子的分子,所以B为HCl,C为H2S,H2S的结构与水分子的结构相似均为“V”型的极性分子。
(3)因为D分子中含有4个原子、2种元素、18个电子,且在溶液中加入MnO2后生成无色气体,所以D为H2O2 。反应的化学方程式为2H2O2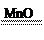 2H2O+O2↑。
2H2O+O2↑。
(4)因为1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,所以1个E分子中含有1个C原子和4个H原子。又因为E分子中含有6个原子且为18电子分子,因此E中含有的另一个原子为O原子。因此E的化学式为CH4O。
本题难度:一般
4、选择题 2011年3月11日日本发生了9.0级的大地震,地震导致了福岛第一核电站受损,泄漏出了人工放射性核素碘-131。该核素在自然界中不存在,是核裂变的产物之一,有放射性,而碘元素的另一种核素碘-127广泛存在于自然界中,是稳定碘,无放射性。下列相关说法正确的是
A.碘元素的相对原子质量是131
B.131I2与127I2性质相同
C.碘元素位于周期表的第五周期第Ⅶ族
D.一个131I原子中含有53个质子
参考答案:D
本题解析:
正确答案:D
A、不正确,碘元素的相对原子质量是碘的各种核素相对原子质量的平均值;B、不正确,化学性质相同;C、不正确,碘元素位于周期表的第五周期第ⅦA族。
本题难度:一般
5、选择题 下列说法中正确的是
A.分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液
B.HClO、Na2O2、O3均具有漂白性,原理是它们均具有强氧化性
C.所有烷烃和糖类中都存在碳碳单键
D.配制Fe2(SO4)3溶液时,需加入Fe粉和稀硫酸
参考答案:B
本题解析:分析:A.根据不同分散系分散质粒子直径:浊液>胶体>溶液;
B.根据HClO、Na2O2、O3均具有强氧化性,可用于漂白;
C.根据烷烃和糖类的分子结构;
D.根据Fe3+易水解,水解呈酸性,具有氧化性,可与铁粉反应;
解答:A.分散系中分散质粒子的大小:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液,故A错误;
B.HClO、Na2O2、O3均具有强氧化性,可用于漂白,故B正确;
C.甲烷中只含有碳氢键,故C错误;
D.Fe3+易水解,水解呈酸性:Fe3++3OH-?Fe(OH)3+3H+,为了防止水解,常常往溶液中加入少量的硫酸,但不能加入铁粉,故D错误;
故选:B;
点评:本题主要考查了物质的分类、物质的结构、性质等知识,难度不大,根据所学知识即可完成.
本题难度:困难