微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是?
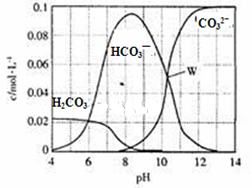
A.W点所示的溶液中:c (Na+)+c (H+)=2c(CO32- )+c (OH-)+c (Cl-)
B.pH= 4的溶液中:c (H2CO3)+c (HCO3-)+c (CO32-)<0.1mol·L-1
C.pH=8的溶液中:c (H+)+c (H2CO3)+c (HCO3-)= c (OH-)+c (Cl- )
D.pH=11的溶液中:c (Na+)>c (Cl-)>c (CO32- )>c (HCO3- )>c (H2CO3)
参考答案:B
本题解析:A.在W点c (HCO3- )= c(CO32- ).根据电荷守恒可得:c (Na+)+c (H+)=2c(CO32- )+c (OH-)+c (Cl-)+ c (HCO3- )。=3c(CO32- )+c (OH-)+c (Cl-)。错误。B.在pH= 4的溶液中H2CO3会发生分解反应产生CO2气体逸出,因此c (H2CO3)+c (HCO3-)+c (CO32-)<0.1mol/L。正确。C.在pH=8的溶液中:c (Na+)+c (H+)= c (OH-)+c (Cl- ) +c (HCO3-)+2c(CO32- )。错误。D.pH=11的溶液中:c (Na+)>c (CO32- )>c (Cl-)>c (HCO3- )>c (H2CO3)。错误。
本题难度:一般
2、选择题 25℃时,1 mol/L的NH4Cl、CH3COONH4、NH4HSO4、NH3·H2O四种溶液中,测得c(NH)分别为a、b、c、d(单位为mol/L),下列判断正确的是(?)
A.a=b=c=d
B.a>b>d>c
C.d >a>c>b
D.c>a>b>d
参考答案:D
本题解析:氨水是弱碱在溶液中部分电离,其余均为盐在溶液中全电离,所以氨水中铵根离子的浓度最小即d最小;根据铵根离子的水解平衡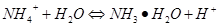 ,NH4HSO4溶液中存在氢离子会抑制铵根的水解溶液中铵根离子的浓度最大,醋酸根离子是弱酸根离子会促使铵根的水解平衡向右移动,铵根离子浓度减小,氯离子对铵根的水解平衡没有影响,综上可以得出c(NH)大小顺序为c>a>b>d,所以答案选D。
,NH4HSO4溶液中存在氢离子会抑制铵根的水解溶液中铵根离子的浓度最大,醋酸根离子是弱酸根离子会促使铵根的水解平衡向右移动,铵根离子浓度减小,氯离子对铵根的水解平衡没有影响,综上可以得出c(NH)大小顺序为c>a>b>d,所以答案选D。
本题难度:简单
3、选择题 已知在常温下测得浓度均为0.1mol?L-1的下列三种溶液的pH:
| 溶质 | NaHCO3 | Na2CO3 | NaCN
pH
8.4
11.6
11.1
|
下列说法中正确的是( )
A.阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3
B.相同条件下的酸性:H2CO3<HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na2CO3溶液的温度,?减小
参考答案:
A.NaHCO3、Na2CO3、NaCN三种盐,都是强电解质,它们的电离方程式分别为:
NaHCO3=Na++HCO3-,HCO3-?H++CO32-?(非常微弱),Na2CO3=2Na++CO32-,NaCN═Na++CN-,从它们的电离方程式可以看出,当浓度相同时,Na2CO3?电离出的阳离子Na+浓度大,考虑水解产生的阳离子;阴离子水解产生阴离子,所以,从上述方程式可看出,阳离子的物质的量浓度之和:Na2CO3>NaHCO3>NaCN.故A错误;?
B.NaHCO3的水解离子方程式为:HCO3-+H2O?H2CO3+OH-,Na2CO3的水解离子方程式分两步,第一步为:CO32-+H2O?HCO3-+OH-(以第一步为主),第二步为:HCO3-+H2O?H2CO3+OH-,NaCN的水解离子方程式为:CN-+H2O?HCN+OH-,盐类水解的规律是,越弱越水解,即酸越弱,其盐中的酸根离子水解程度越大.浓度均为0.1mol?L-1的NaHCO3、Na2CO3、NaCN三种盐溶液PH:pH(Na2CO3)>pH(NaCN)>pH(NaHCO3),说明酸性:H2CO3>HCN.故B错误;
C.浓度均为0.1mol?L-1的NaHCO3、Na2CO3、NaCN三种盐溶液,PH都不等于7,说明存在水解平衡.
它们的盐溶液,都有水,水也是弱电解质,说明存在电离平衡.故C正确;
D.影响水解平衡进行程度最主要因素是盐本身的性质,外界条件对平衡移动也有影响,水解反应为吸热反应,升高温度,促进盐溶液中CO32- 水解,Na2CO3的水解离子方程式分两步,第一步为:CO32-+H2O?HCO3-+OH-(以第一步为主),第二步为:HCO3-+H2O?H2CO3+OH-,从水解的离子方程式可看出C(HCO3-)C(CO32-)增大.故D错误;
故选C.
本题解析:
本题难度:一般
4、选择题 下列实际应用与盐的水解知识无关的是
A.焊接时用NH4Cl溶液除锈
B.泡沫灭火器中用硫酸铝与饱和小苏打溶液
C.饱和氯化铁溶液滴入沸水制备Fe(OH)3胶体
D.生活中电解食盐水制取消毒液
参考答案:D
本题解析:A正确,铵根离子水解使溶液呈酸性,铁锈可以溶于酸性溶液中。
B正确,铝离子和碳酸氢根离子双水解。
C正确,铁离子水解。
D错误,氯化钠不水解,电解是外加电源作用下的氧化还原反应。答案选D
本题难度:简单
5、选择题 常温下在20 mL 0.1 mol/L Na2CO3溶液中逐渐滴加入0.1 mol/L HCl溶液40 mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示,下列说法不正确的是
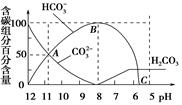
A.0.1 mol/L Na2CO3溶液中c(OH-)-c(H+)=2c(H2CO3)+c(HCO3-)
B.在A点c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C.常温下CO2饱和溶液的pH约为5.6
D.0.05 mol/L NaHCO3溶液的pH=8
参考答案:B
本题解析:选项A符合质子守恒,正确。碳酸钠和盐酸反应是分步进行的,反应式为Na2CO3+HCl
=NaHCO3+NaCl、NaHCO3+HCl=NaCl+CO2↑+H2O。根据图像可知,A点CO32-和HCO3-的含量是相同的,所以选项B不正确。在C点CO32-和HCO3-的含量接近0,此时是CO2的饱和溶液,溶液的pH=5.6,所以选项C正确。当溶液中CO32-的含量为0时,溶液中只有溶质NaHCO3,其浓度是0.05mol/L,根据图像可知,此时溶液的pH=8,D正确。答案选B。
本题难度:一般