微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 以天然气为原料经合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线,以甲烷的部分氧化为基础制备甲醚(CH3OCH3)和甲醇的工业流程如下
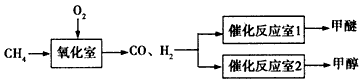
(1)甲烷的部分氧化反应如下:2CH4(g) +O2(g)=2CO(g) +4H2(g) △H=-71.2 kJ/mol
有研究认为甲烷部分氧化的机理为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=- 890.3 kJ/mol
②CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2
③CH4(g)+H2O(g)=CO(g) +3H2(g) △H3=+250.3 kJ/mol 则△H2=____。
(2)催化反应室1中合成甲醚的反应为:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),该反应为自发反应,则该反应的△H___________(填“<”、“>”或“=”)0。
CH3OCH3(g)+H2O(g),该反应为自发反应,则该反应的△H___________(填“<”、“>”或“=”)0。
(3)催化反应室2中发生如下反应:CO(g) +2H2(g)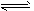 CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图a所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是___;都达到化学平衡状态时,CO转化率最低的是___。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图a所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是___;都达到化学平衡状态时,CO转化率最低的是___。
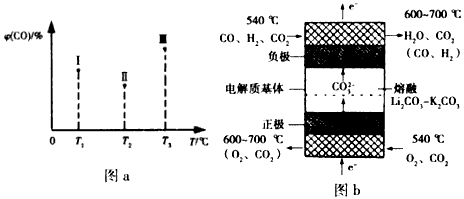
(4)如图b为熔融碳酸盐燃料电池的工作原理示意图。熔融碳酸盐燃料电池的正极反应式可表示为:____。
2、选择题 以30%KOH溶液为电解质溶液的氢氧燃料电池,电极反应如下:2H2+4OH--4e-=4H2OO2+2H2O+4e-=4OH-据此判断,下列说法中错误的是( )
A.H2在负极发生氧化反应
B.供电时的总反应为:2H2+O2=2H2O
C.燃料电池的能量转化率可达100%
D.产物无污染,属于环境友好电池
3、填空题 如图甲、乙是电化学实验装置。
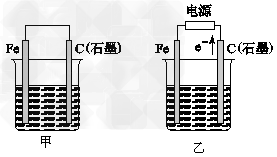
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为_______________________________;
②乙中总反应的离子方程式为____________________________;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了I-生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为_________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为_____________________________;
②如果起始时乙中盛有200?mL?pH=5的CuSO4溶液(25?℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入__________(填写物质的化学式)________g。
4、选择题 下列说法正确的是
A.在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。2CO2(g)+6H2(g)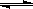 CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应
CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应
B.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解去除
C.室温下,将浓度为0.1mol.L?1HF溶液加水稀释,其电离平衡常数和c(H+)/c(HF)均不变
D.电解精练铜时,阳极泥中常含有金属金、银、锌等。
5、实验题 (15分)现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)(A) (B) 。
(2)如果(A或B)不能,说明其原因 。
(3)如果(A或B)可以,则写出正、负极材料及其电极反应式,电解质溶液
负极: ; 。
正极: ; 。
电解质溶液: 。