微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
A.根据表中数据不能计算出混合物中NaHCO3的质量分数
B.加入混合物9.2 g时盐酸过量
C.盐酸的物质的量浓度为3.0mol·L-1
D.15.7 g混合物恰好与盐酸完全反应
参考答案:AD
本题解析:9.2g混合物与50mL盐酸反应生成2.24L CO2,则生成3.36L CO2气体需混合的质量为13.8 g,所以D错误,同时可知B正确;根据第一组数据50mL盐酸与9.2g混合物反应生成2.24L CO2,可计算出NaHCO3的质量分数,解题过程如下:
设:9.2g混合物中NaHCO3的物质的量为x,KHCO3的物质的量为y
则:84x+100y=9.2
X+y=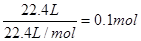 得x="0.05mol" ; y=0.05mol进而可求NaHCO3的质量分数,所以A错;根据第二组数据50mL盐酸与15.7g混合物反应生成3.36L CO2,且混合物过量,即盐酸完全反应,根据离子方程式:H++HCO3-=CO2↑+H2O,HCL与CO2的关系为1:1可知HCL的物质的量为0.15mol,即可求得盐酸的物质的量浓度为3.0mol·L-1
得x="0.05mol" ; y=0.05mol进而可求NaHCO3的质量分数,所以A错;根据第二组数据50mL盐酸与15.7g混合物反应生成3.36L CO2,且混合物过量,即盐酸完全反应,根据离子方程式:H++HCO3-=CO2↑+H2O,HCL与CO2的关系为1:1可知HCL的物质的量为0.15mol,即可求得盐酸的物质的量浓度为3.0mol·L-1
本题难度:简单
2、选择题 铝热反应可应用于焊接钢轨,还应用于冶炼高熔点金属如钒、铬、锰等.这是利用了铝的
①还原性?
②导电性
③与强酸和强碱均反应
④被氧化的过程放出大量的热.
A.①
B.①④
C.①③④
D.①②③④
参考答案:B
本题解析:分析:铝热反应中,铝失电子而作还原剂,且该反应是放热反应.
解答:铝热反应中,铝失电子化合价升高而作还原剂,还原剂具有还原性,且该反应中放出大量热而冶炼高熔点金属,故选B.
点评:本题考查了铝热反应,明确铝热反应的原理是解本题关键,难度不大.
本题难度:一般
3、选择题 下表列举的各组事实中存在因果关系的是
A.A
B.B
C.C
D.D
参考答案:A
本题解析:分析:陈述Ⅰ和陈述Ⅱ相比较,如果存在因果关系,必须是陈述Ⅰ是陈述Ⅱ变化的原因,能解释陈述Ⅱ的结论正确,分析各项性质对比成因即可做出判断.
解答:A、因为高纯单质硅具有半导体性能,所以制成的光电池才可将光能直接转化为电能,故A正确;
B、钠原子核外电子数比铝少,不是钠的金属性比铝强的原因,失电子的难易是钠的金属性比铝强的原因,故B错误;
C、氯的非金属性比碘强,说明氯气氧化性比碘单质强,但I2与KClO3反应生成Cl2和KIO3,是利用了KClO3的氧化性把I2氧化为KIO3,本身被还原为氯气,此反应中说明碘单质的还原性比氯气强,前后无因果关系,故C错误;
D、N2+3H2≒2NH3是放热反应,降低温度有利于平衡正向进行,生成更多的氨气,但温度低速率小,工业合成氨的反应在高温下进行的原因是提高速率同时催化剂在此温度下活性最大,所以前后无因果关系,故D错误;
故选A.
点评:本题考查了元素化合物的性质及原因,主要考查晶体硅的导电性应用、金属活泼性的比较依据、氧化还原反应的规律应用、工业合成氨条件选择的原因.
本题难度:一般
4、选择题 下列关于Cl、N、S等非金属元素化合物的说法正确的是
A.漂白粉的成分是次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH处理NO2和HCl废气
D.用饱和食盐水吸收氯气的尾气,以达环境保护
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列物质中,不能与氢氧化钠溶液发生反应的是
A.Fe
B.Al2O3
C.NaHCO3
D.CO2
参考答案:A
本题解析:Al2O3是两性氧化物,可与碱反应。NaHCO3在溶液里电离出HCO3-,也是既可与碱反应,也能与酸反应。CO2是酸性氧化物,可与NaOH反应。一般情况下,很少有金属直接与碱作用。所以正确答案为A。
本题难度:简单