微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)
用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)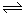 1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
②CaSO4(s)+CO(g)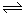 CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
③CO(g)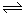 1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
(1)反应2 CaSO4(s)+7CO(g)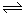 CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=?(用△H1△H2△H3表示)。
CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=?(用△H1△H2△H3表示)。
(2)反应①~③的平衡常数的对数lgK随反应温度T的变化曲线见图18.结合各反应的△H,归纳lgK~T曲线变化规律:
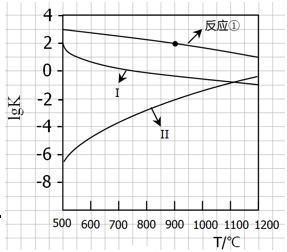
a)?
b)??
(3)向盛有CaSO4的真空恒容容器中充入CO,反应①于900 ?C达到平衡,c平衡(CO)=8.0×10-5mol·L-1,计算CO的转化率(忽略副反应,结果保留2位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入?。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生成CaSO4,该反应的化学方程式为?;在一定条件下CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为?。
参考答案:(1)4△H1+△H2+2△H3;
(2)a)、放热反应的lgK随温度升高而下降; b)、放出或吸收热量越大的反应,其lgK受温度影响越大;
(3)99%
(4)CO2
(5)CaS+2O2 CaSO4,
CaSO4,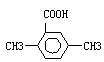
本题解析:(1)根据盖斯定律可得2 CaSO4(s)+7CO(g) CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=①×4+②+③×2=4△H1+△H2+2△H3;
CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=①×4+②+③×2=4△H1+△H2+2△H3;
(2)由图像及反应的△H可知,a)、反应①③是放热反应,随温度升高,lgK降低;反应②是吸热反应,随温度升高,lgK增大;b)、从图像上看出反应②、③的曲线较陡,说明放出或吸收热量越大的反应,其lgK受温度影响越大;
(3)由图可知,反应①于900 ?C的lgK=2,则K=100, c平衡(CO)=8.0×10-5mol·L-1,平衡时c平衡(CO2)=100×8.0×10-5mol·L-1=8.0×10-3mol·L-1,根据反应1/4CaSO4(s)+CO(g) 1/4CaS(s)+CO2(g)可知,消耗CO的浓度是8.0×10-3mol·L-1,则开始时c(CO)=8.0×10-5mol·L-1+8.0×10-3mol·L-1=8.08×10-3mol·L-1,所以CO的转化率为8.0×10-3mol·L-1/8.08×10-3mol·L-1×100%=99%,;
1/4CaS(s)+CO2(g)可知,消耗CO的浓度是8.0×10-3mol·L-1,则开始时c(CO)=8.0×10-5mol·L-1+8.0×10-3mol·L-1=8.08×10-3mol·L-1,所以CO的转化率为8.0×10-3mol·L-1/8.08×10-3mol·L-1×100%=99%,;
(4)根据方程式可知,二氧化碳中含有气体杂质SO2,可在CO中加入适量的CO2,抑制二氧化硫的产生;
(5)CaS转化为CaSO4,从元素守恒的角度分析,CaS与氧气发生化合反应,原子的利用率100%,生成CaSO4,化学方程式为CaS+2O2 CaSO4,CO2与对二甲苯发生反应,所得产物中含有羧基,因为苯环的氢原子只有1种,所以产物的结构简式只有1种为
CaSO4,CO2与对二甲苯发生反应,所得产物中含有羧基,因为苯环的氢原子只有1种,所以产物的结构简式只有1种为 。
。
本题难度:困难
2、选择题 下列化学反应ΔH的数值中,表示放热最多的是
[? ]
A.NaOH(aq)+HCl(aq)=NaCl(aq )+H2O(l);△H1
B.NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l);△H2
C.CH3COOH(aq)+NaOH(aq)=CH3COONa (aq )+H2O(l);△H3
D.NaOH(aq)+1/2H2SO4(浓)=1/2Na2SO4(aq)+H2O(l);△H4
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列各组中的两个反应,前一个反应放出的热量比后一个反应放出的热量多的是(反应物参与反应的物质的量均按化学方程中的化学计量数计算,且g、l、s分别表示物质的状态为气、液、固态)( )
①2H2(g)+O2(g)=2H2O(g)?2H2(g)+O2(g)=2H2O(l)
②C(s)+O2(g)=CO2(g)?C(s)+O2(g)=CO(g).
A.只有①
B.只有②
C.①②
D.①②都不符合题意
参考答案:①反应?2H2(g)+O2(g)=2H2O(g)可以看成是反应2H2(g)+O2(g)=2H2O(l)和2H2O(l)=2H2O(g)的合并结果,2H2(g)+O2(g)=2H2O(l)放热,但是2H2O(l)=2H2O(g)吸热,两个反应的焓变和代数值要比前者大,所以前一个反应放出的热量比后一个反应放出的热量少,故①错误;
②碳完全燃烧产生的热量要比不完全燃烧释放的热量高,故前一个反应放出的热量比后一个反应放出的热量多,故②正确.
故选②.
本题解析:
本题难度:简单
4、选择题 在同温同压下,下列各组热化学方程式中ΔH1>ΔH2的是?
[? ]
A.2H2(g)+O2(g)?==2H2O(l);ΔH1?2H2(g)+O2(g)==2H2O(g);ΔH2
B.S(g)+O2(g)?==2SO2(g);ΔH1?S(s)+O2(g)==2SO2(g);ΔH2
C.C(s)+?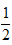 O2(g)==CO(g);ΔH1?C(s)+O2(g)==CO2(g);ΔH2
O2(g)==CO(g);ΔH1?C(s)+O2(g)==CO2(g);ΔH2
D.H2(g)+Cl2(g)?==2HCl(g);ΔH1?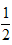 H2(g)+?
H2(g)+? Cl2(g)?==?HCl(g);ΔH2
Cl2(g)?==?HCl(g);ΔH2
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列反应均为放热反应,其中热化学方程式中△H最小的是
[? ]
A. 2A ( l ) + B ( l ) = 2C (g ) △H1
B. 2A ( g ) + B ( g ) = 2C (g ) △H2
C. 2A ( g ) + B ( g ) = 2C ( l ) △H3
D. 2A ( l ) + B ( l ) = 2C ( l ) △H4
参考答案:C
本题解析:
本题难度:一般