|
高中化学知识点大全《焓变、反应热》高频试题特训(2017年最新版)(六)
2017-08-22 14:20:30
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于能量判据和熵判据的说法中,不正确的是( )
A.放热的自发过程可能是熵减小的过程,吸热的自发过程一定为熵增加的过程
B.由能量判据和熵判据组合成的复合判据,将更适合于所有的过程
C.在室温下碳酸钙的分解反应不能自发进行,但同样是这个吸热反应在较高温度(1200?K)下则能自发进行
D.放热过程(△H<0)或熵增加(△S>0)的过程一定是自发的
参考答案:A.反应自发进行的判断依据是△H-T△S<0,自发进行的反应也需要一定条件才可以发生,放热的自发过程,△H<0,△S可能小于0也可能大于0,所以,放热的自发过程可能是熵减小的过程,吸热的自发过程,△H>0,因T>0,须△H-T△S<0,取决于△S>0,所以吸热的自发过程一定为熵增加的过程,故A正确;
B.化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H-T?△S<0时,反应能自发进行,当△H<0,△S>0时,△G=△H-T?△S<0,一定能自发进行,而△H>0,△S<0时不能自发进行,△H>0,△S>0或△H<0,△S<0能否自发进行,取决于反应的温度,所以,由能量判据和熵判据组合成的复合判据,将更适合于所有的过程,故B正确;
C.在室温下碳酸钙的分解反应不能自发进行,△H-T△S>0,因△H>0,△S>0所以当反应温度高到一定程度,T△S>△H,此时△H-T△S<0,反应能自发进行,故C正确;
D.当△G=△H-T?△S<0时,反应能自发进行,当△H<0,△S>0时,△G=△H-T?△S<0,一定能自发进行,而△H>0,△S<0时不能自发进行,△H>0,△S>0或△H<0,△S<0能否自发进行,取决于反应的温度,故D错误;
故选D.
本题解析:
本题难度:一般
2、选择题 如图所示,△H1=-393.5kJ-mol-1,△H2=-395.4kJ-mol-1,下列说法或表示式正确的是( )
A.C(s、石墨)═C(s、金刚石),该反应的焓变为负值
B.石墨的稳定性弱于金刚石
C.石墨和金刚石的转化是物理变化
D.1?mol石墨的总键能比1?mol金刚石的总键能大1.9?kJ
| 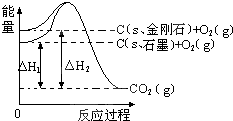
参考答案:由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
? ②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ?mol-1,
A、利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ?mol-1,故A错误;
B、由C(S,石墨)=C(S,金刚石)△H=+1.9kJ?mol-1,金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,故B错误;
C、石墨和金刚石是不同的两种物质,石墨转化为金刚石属于化学变化,故C错误;
D、由 C(S,石墨)=C(S,金刚石)△H=+1.9kJ?mol-1,1 mol石墨的总键能比1 mol金刚石的总键能大于1.9 kJ,故D正确;
故选:D.
本题解析:
本题难度:一般
3、填空题 (I某氮肥厂氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如下:

(1)1 mo1NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是? _?。
(2)在一定条件下,向废水中加入CH3OH,将HNO3还原成 N2,若该反应消耗32gCH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是_?。
(B)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术
将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO十2CO 2CO2+ N2?△H 2CO2+ N2?△H
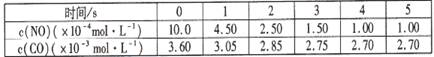
某温度下用气体传感器测得不同的时间的NO和CO浓度如下表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H?0(填写“>”、“<”、“=”)
(2)在该温度下,反应的平衡常数K=?(只写出计算结果);
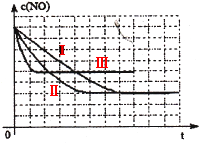
(3)某同学设计了三组实验,分别验证温度、催化剂比表面积对化学反应速率的影响规律,
部分实验条件如下表:

该同学画出了表中三个实验条件下,混合气体中NO浓度随时间变化的趋势曲线图,请在图上标明各条曲线的实验编号; 
参考答案:(I)(1)NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)?
△H=-346kJ·mol-1
(2)5:6
(Ⅱ)(1)<
(2)5000
(3)见图
本题解析:(I)(1)NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)?
1 mo1NH4+(aq)全部氧化成NO3-(aq)的热化学方程式中△H为第一步反应和第二部反应之和即为:-346kJ·mol-1;(2)32gCH3OH的物质的量为1mol,转移电子6mol表示氧化剂HNO3得到6mol电子,由于HNO3中N元素有+5价将为N2中的0价因此需要1.2molHNO3参与反应。因此参加反应的还原剂CH3OH和氧化剂HNO3的物质的量之比是5:6。
(Ⅱ)(1)此反应为气体体积缩小的反应△S<0,由于反应能够自发进行因此△G=△H-T△S<0,因此
△H<0
(2)? 2NO?+?2CO? ?2CO2?+? N2 ?2CO2?+? N2
始:10.0×10-4?3.6×10-3? 0? 0
变:9.00×10-4? 9.00×10-4? 9.00×10-4? 4.50×10-4
终:1.00×10-4? 2.7×10-3? 9.00×10-4? 4.50×10-4
由公式计算可得K=5000
(3)Ⅱ对比I增加了催化剂的比表面积,催化剂只会缩短达到平衡的时间并不影响平衡的移动;Ⅲ对比Ⅱ提高了反应的温度,平衡向吸热方向移动,即向逆反应方向移动c(NO)提高。
本题难度:困难
4、选择题 已知:C(s)+O2(g)=CO2(g)?△H1
CO2(g)+C(s)=2CO(g)?△H2
2CO(g)+O2(g)=2CO2(g)?△H3
4Fe(s)+3O3(g)=2Fe2O3(s)?△H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)?△H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
参考答案:C
本题解析:A、碳和CO燃烧均是放热反应,△H1<0,A不正确;B、二氧化碳与碳反应是吸热反应,铁在氧气中燃烧是放热反应,△H4<0,B不正确;C、②CO2(g)+C(s)=2CO(g)?△H2,③2CO(g)+O2(g)=2CO2(g)?△H3,则根据盖斯定律可知②+③即得到C(s)+O2(g)=CO2(g) ,△H1=△H2+△H3,C正确;D、已知④4Fe(s)+3O3(g)=2Fe2O3(s)?△H4,⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)?△H5,则根据盖斯定律可知(④+⑤×2)÷3得到2CO(g)+O2(g)=2CO2(g),则△H3= ,D不正确,答案选C。 ,D不正确,答案选C。
本题难度:一般
5、选择题 下列变化过程中,△S<0的是( )
A.水蒸气凝结成水滴
B.硝酸铵固体溶于水
C.氮气和氧气混合
D.碳酸氢铵固体分解为NH3、H2O(g)和CO2
参考答案:A、水蒸气凝结成水滴,混乱度减小,△S<0,故A正确;
B、硝酸铵固体溶于水,电离形成离子,△S>0,故B错误;
C、氮气和氧气混合,N2+O2=2NO,反应前后气体体积不变,熵变不变,故C错误;
D、碳酸氢铵固体分解为NH3、H2O(g)和CO2 气体体积增大,反应后熵变增大,△S>0,故D错误;
故选A.
本题解析:
本题难度:一般
| 