微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知:CO(g)+H2O(g) CO2(g)+H2(g)? △H= -42kJ·mol-1
CO2(g)+H2(g)? △H= -42kJ·mol-1
(1)在一定温度下,向一定体积的密闭容器中通入1molCO、2molH2O(g),反应达平衡时,测得放出的热量为28kJ,求CO的转化率为?;
(2)该温度下,向该密闭容器中通入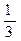 molCO2、
molCO2、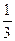 molH2,欲使反应达平衡时CO的转化率与(1)相同,则还需满足的条件是?;
molH2,欲使反应达平衡时CO的转化率与(1)相同,则还需满足的条件是?;
(3)该温度下,向该密闭容器中通入2molCO、3molH2O(g),反应达平衡时时,求H2O(g)的转化率?;
(4)该温度下,向该密闭容器中通入1.5molCO、3molH2O(g),反应达平衡时,放出的热量为?kJ。
2、选择题 下图是温度和压强对X+Y 2Z反应影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z反应影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
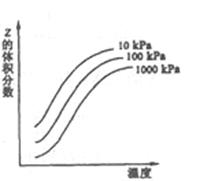
A.X、Y、Z均为气态
B.恒容时,混合气体的密度可作为此反应是否达到化学平衡[的判断依据
C.升高温度时 增大,
增大,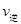 减小,平衡向右移动
减小,平衡向右移动
D.使用催化剂Z的产率增加
3、选择题 对于反应M+N→P,如果温度每升高10℃,速率增大为原来的3倍,在10℃时,完成反应10%需81min,则在30℃时完成反应10%需要时间为 ?
[ ]
A.27min
B.9min
C.13.5min
D.3min
4、填空题 某温度时,在2 L容器中X、Y、Z三种物质随时间的变化曲线如图所示:
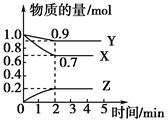
(1)由图中的数据分析,该反应的化学方程式为__________________________。
(2)反应开始至2 min时Z的平均反应速率为____________。
5、选择题 (10分)(1)已知可逆反应:M(g)+N(g) P(g)+Q(g)?ΔH>0,
P(g)+Q(g)?ΔH>0,
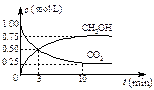
若要增大Q的浓度,在其它条件不变的情况下可以采取的措施为?(填序号)。
A.加入一定量M? B.降低反应温度? C.升高反应温度?
D.缩小容器体积? E.加入催化剂? F.分离出一定量P
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)?△H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)?△H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)?△H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________?。
(3)在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g)? ΔH=-49.0 kJ/mol, 测
CH3OH(g)+H2O(g)? ΔH=-49.0 kJ/mol, 测
得CO2和CH3OH(g)的浓度随时间变化如右图所示。
①从3 min到10 min,v(H2)=?mol/(L·min)。
②能说明上述反应达到平衡状态的是?(选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是?(选填编号)。
A.升高温度? B.恒温恒容充入He(g)
C.将H2O(g)从体系中分离? D.恒温恒容再充入1 mol CO2和3 mol H2