微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把0.05molBa(OH)2固体分别加入到下列100mL液体中,溶液导电性变化不大.该液体是( )
A.自来水
B.1.0mol/L盐酸
C.0.5mol/L硫酸
D.1.0mol/L氨水
参考答案:A.水中离子浓度较小,加入少量的氢氧化钡固体后,离子浓度增大导电能力增强,故A错误;
B.向盐酸溶液中加入0.05molBa(OH)2固体,盐酸和氢氧化钡反应生成氯化钡和水,电解质氯化氢转变为氯化钡,都是强电解质,溶液离子浓度变化不大,只是离子的转化,所以溶液导电能力变化不大,故B正确;
C.向硫酸溶液中加入0.05molBa(OH)2固体,硫酸和氢氧化钡反应生成硫酸钡和水,电解质硫酸转变为水,溶液导电能力减弱,故C错误;
D.氨水的电离程度很小,导电能力较弱,加入0.05molBa(OH)2固体后,离子浓度增大导电能力增强,故D错误.
故选B.
本题解析:
本题难度:简单
2、选择题 下列反应的离子方程式错误的是(? )
A.向硫酸铝的溶液中加入过量的KOH溶液:Al3++4OH-====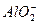 +2H2O
+2H2O
B.向硝酸银溶液中加入过量的氨水:Ag++2NH3·H2O====[Ag(NH3)2]++2H2O
C.Ca(HCO3)2溶液与过量Ca(OH)2反应:Ca2++2OH-+2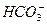 ====CaCO3↓+
====CaCO3↓+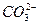 +2H2O
+2H2O
D.次氯酸钙溶液中通入过量的CO2:ClO-+CO2+H2O====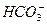 +HClO
+HClO
参考答案:C
本题解析:C项忽略Ca2+的来源,Ca2+过量生成物中无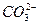 ,应为Ca2++OH-+
,应为Ca2++OH-+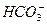 ====CaCO3↓+H2O;D项在次氯酸钙溶液中通CO2气体,先有CaCO3沉淀生成,再继续通入,生成可溶性的碳酸氢钙,D项正确。
====CaCO3↓+H2O;D项在次氯酸钙溶液中通CO2气体,先有CaCO3沉淀生成,再继续通入,生成可溶性的碳酸氢钙,D项正确。
本题难度:简单
3、选择题 下列反应的离子方程式中,书写正确的是
A.钠跟水反应:2Na + 2H2O = 2Na+ + 2OH-+ H2↑
B.铁粉跟稀硫酸反应:2Fe + 6H+ = 2Fe3++ 3H2↑
C.氢氧化钡溶液跟稀硫酸反应:Ba2+ + SO42-= BaSO4↓
D.碳酸钙跟盐酸反应:CO32-+ 2H+ = H2O + CO2↑
参考答案:A
本题解析:B中应生成Fe2+;
C中还会生成弱电解质水;
D中碳酸钙为难溶物,不可拆;
本题难度:困难
4、填空题 某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SiO32-、SO42-、NO3-中的一种或几种离子。为确定溶液X的成分,进行如下实验:
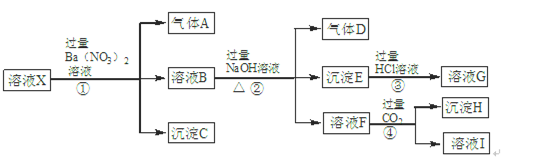
根据以上信息,请回答下列问题:
(1)溶液X中肯定不含有的离子是?,不能确定是否含有的离子是?,若要确定是否含有这种离子,最可靠方法是:?
?。
(2)溶液I中所含溶质有?(填化学式)。
(3)步骤①②③④中,发生符合“强酸制弱酸”反应的步骤是?(填序号)。
(4)步骤①中生成气体A的离子方程式是?。
参考答案:(1)Ba2+、CO32-、SiO32-、NO3- (每个1分,共4分)?Fe3+(1分)
取少量X溶液于试管中,在其中滴加几滴KSCN溶液,若溶液不显血红色则说明没有Fe3+,若显血红色则说明含有Fe3+(2分)
(2)NaNO3、NaHCO3、Ba(NO3)2?(CO2、H2CO3不作要求)(每个1分,共3分) ?
(3)④(1分)?(4)3Fe2++NO3- +4H+=3Fe3++NO↑+2H2O (2分)
本题解析:(1)题干中强酸性溶液中一定不含CO32-、SiO32-;NO3-与Fe2+不能同时存在;根据转化关系中X溶液中加入过量硝酸钡生成气体沉淀和溶液的反应,依据离子性质推断溶液中一定含Fe2+,一定不含NO3?;酸性溶液中硝酸根离子具有强氧化性,加入Ba(NO3)2后得到气体A为NO,D为NO2;沉淀C为硫酸钡,判断溶液中一定含SO42-;根据离子共存判断原溶液中一定不含Ba2+;溶液B中一定含有Fe3+;B溶液和过量氢氧化钠反应生成气体、沉淀、溶液,推断原溶液中一定含NH4+;生成的沉淀E是Fe(OH)3;与碱反应生成的气体D为NH3;溶液F通入过量二氧化碳生成沉淀,判断溶液H中含有AlO2-;证明原溶液中一定含有Al3+;沉淀H为Al(OH)3;原溶液中一定含有Al3+、NH4+、Fe2+、SO42-;一定不含Ba2+、CO32-、SiO32-、NO3-;可能含有的Fe3+;用KSCN溶液可检验是否含有Fe3+。
(2)溶液F加入过量的CO2得到的溶液I,一定含有生成的NaHCO3、第①②步剩余和生成的NaNO3和Ba(NO3)2。
(3)①为Ba2+与SO42?反应、NO3?和H+氧化Fe2+;②NaOH与NH4+和Fe3+反应;③为Fe(OH)3与HCl的反应;④为CO2、H2O与AlO2-生成Al(OH)3的反应,所以符合“强酸制弱酸”反应为④。
(4)步骤①中生成气体A为NO3?、H+氧化Fe2+,配平可得离子方程式:)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 。
本题难度:一般
5、选择题 向明矾溶液中逐滴加入Ba(OH)2溶液至铝离子全部转变为[Al(OH)4]-时,溶液呈
A.酸性
B.中性
C.碱性
D.无法比较
参考答案:C
本题解析:
本题难度:困难