微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 门捷列夫在研究周期表时预言了包括“类铝”、“类硅”在内的11种元素。
(1)门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。
①已知主族元素锗的最高化合价为+4价,其最高价氧化物的水化物为两性氢氧化物。试比较元素的非金属性Si________Ge(用“>”或“<”表示)。
②若锗位于硅的下一周期,写出“锗”在周期表中的位置________。根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是________。
③硅和锗单质分别与H2反应时,反应较难进行的是________(填“硅”或“锗”)。
(2)“类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
①由镓的性质推知,镓与铝同主族,且位于铝的下一周期。试从原子结构的角度解释镓与铝性质相似的原因________________。冶炼金属镓通常采用的方法是________________。
②为判断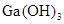 是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液、________和________。
是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液、________和________。
参考答案:(1)①>?第四周期ⅣA族 ② 半导体材料 ③ 锗
(2)① 它们的原子最外层电子数都为3?电解法
② 氢氧化钠溶液?稀硫酸或盐酸
本题解析:本体主要考察元素周期表及元素周期律相关内容。
(1)①由于元素锗最高价化合物为﹢4价,故其位于元素周期表中第四主族,与硅同一主族,且硅最高价氧化物对应的水化物为酸性,锗的最高价氧化物对应水化物为两性,故硅的非金属性大于锗。
② 硅位于第三周期第四主族,锗与硅同一主族,而锗位于第四周期,所以锗在元素周期表的位置为第四周期ⅣA族。?锗与硅同为半导体材料。
③非金属性越强,单子越容易与氢气发生反应,同主族元素随原子序数增大,非金属性渐弱,故硅的非金属性强于锗的非金属性。硅与氢气更容易化合。
(2)① 二者位于同一主族,最外层电子数相同,均为3个。?镓比较活泼,故采用电解法。
②判断物质是否具有两性可观察该物质是否与酸、碱都发生反应。
本题难度:一般
2、选择题 下列说法正确的是
A.BaSO4、Ba(NO3)2、BaCl2最多有3种不同的分类方法
B.CuSO4溶液、Fe、NaOH溶液相互间可以发生两种不同类型的反应
C.Fe2O3、CaO、CO2都是碱性氧化物
D.液态氧、洁净的空气、纯净的盐酸都是纯净物
参考答案:B
本题解析:选项A,可以根据三种盐的组成和性质进行分类,如钡盐、硝酸盐、硫酸盐、盐酸盐、可溶性盐等.选项B,Fe与CuSO4溶液可以发生置换反应,CuSO4溶液可以与NaOH溶液发生复分解反应.选项C,CO2是酸性氧化物.选项D,空气、盐酸都是混合物,这类名词前即便有“纯净”、“洁净”等词修饰,它们也还是混合物.
本题难度:简单
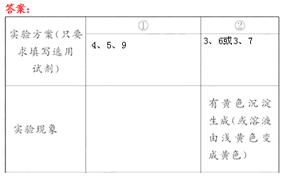
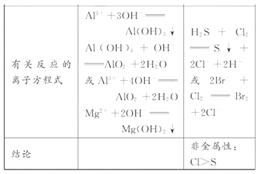
3、实验题 (12分)实验室通过简单的“试管实验”,即可探索元素的金属性、非金属性的强弱,请你选用下列试剂,根据实验要求完成下表。
实验方案(只要求填写选用试剂)
| ①
| ②
|
填试剂序号
| 填试剂序号
|
实验现象
| 一支试管中有白色沉淀,另一支试管中先生成白色沉淀,后白色沉淀消失
| ?
|
有关反应的离子方程式
| ?
| ?
|
结论
| 金属性:Mg>Al
| 非金属性:
|
试剂:①镁条、②铝条、③氯 水、④AlCl3溶液、⑤MgCl2溶液、⑥NaBr溶液、⑦氢硫酸、⑧水、⑨NaOH溶液
水、④AlCl3溶液、⑤MgCl2溶液、⑥NaBr溶液、⑦氢硫酸、⑧水、⑨NaOH溶液
参考答案:共12分,各2分
本题解析:略
本题难度:一般
4、选择题 下列分类或归类正确的是
①液氯、氨水、干冰、碘化银均为纯净物
②CaCl2、NaOH、HCl、IBr均为化合物
③明矾、水银、烧碱、硫酸均为强电解质
④C60、C70、金刚石、石墨均为碳的同素异形体
⑤碘酒、淀粉、水雾、纳米材料均为胶体
A.①③④
B.②③
C.②④
D.②③④⑤
参考答案:C
本题解析:试题分析:氨气溶于水得到氨水,氨水属于混合物,①不正确;CaCl2、NaOH、HCl、IBr均为两种或两种以上元素组成的纯净物,都是化合物,②正确;水银是单质,不是电解质,也不是非电解质,③不正确;C60、C70、金刚石、石墨均为碳元素组成的不同单质,都是碳的同素异形体,④正确;分散质微粒的直径介于1nm和100nm之间的分散系称为胶体,碘酒是溶液,淀粉是高分子化合物,纳米材料是指在1nm~100nm尺寸的材料,属于纯净物,水雾是胶体,⑤不正确,答案选C。
考点:考查物质分类的有关判断
本题难度:困难
5、填空题 A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子半径最短;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次外层电子数多4个;④D原子的次外层电子数是最外层电子数的8倍;⑤E单质既能和盐酸反应又能和烧碱反应;⑥F与C同主族。回答下列问题:
(1)在六种元素中,形成物质种类最多的是______(填元素名称);
(2)写出C元素所有的氢化物的电子式______;
(3)用电子式表示D2F的形成过程______;
(4)A2C的沸点比A2F的沸点高的主要原因______;
(5)写出E与烧碱溶液反应的离子方程式______。
参考答案:(12分)(1)碳(2分)

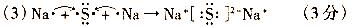
(4)水分子间存在氢键?(2分)
(5)2Al+2OH-+2H2O=2AlO2-+3H2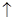 ?(2分)(其它合理答案同样给分)
?(2分)(其它合理答案同样给分)
本题解析:根据元素的结构及应该性质可知, A、B、C、D、E、F六种短周期元素H、C、O、Na、Al、S。
(1)物质种类最多的是有机物,而有机物都是含有碳元素。
(2)氧元素能形成两种氢化物水和双氧水,电子式分别是 。
。
(3)硫化钠是含有离子键的离子化合物,其形成过程可表示为
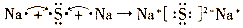 。
。
(4)由于水分子中含有氢键,所以水的沸点高于硫化氢的。
(5)铝和氢氧化钠溶液反应生成氢气和偏铝酸钠,方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。
本题难度:简单