微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 金属钠与水的反应是中学化学中的一个重要反应。在高中化学教材的几次改版中该实验曾出现过几种不同的演示方法,分别如下图中甲、乙、丙所示
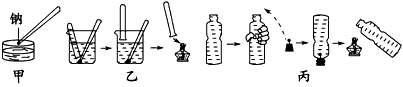
(1)现按图甲所示的方法,在室温时,向盛有Ca(HCO3)2溶液的水槽中加入一小块金属钠。下列现象描述正确的是________
A.钠浮在液面上,并四处游动,最后消失
B.钠熔化成一个光亮的小球
C.反应开始后,溶液由无色变红色
D.恢复到室温时,烧杯底部有固体物质析出
(2)请补充并完成甲实验中从试剂中取出钠到向水槽中投入钠的有关操作;用镊子从试剂中取出一块钠→
______________,用镊子夹取切好的金属钠投入到盛有Ca(HCO3)2溶液的烧杯中。
(3)某同学用镊子夹住一块钠,按图乙所示方法来收集产生的气体,但钠很快脱落,实验没有成功。正确的关键操作是_____________________。
(4)用装满水的矿泉水瓶按图丙方法进行实验,用手挤压矿泉水瓶并塞紧带有钠的塞子,排出水的体积共为16.8 mL,待钠反应结束后,干瘪的带塞矿泉水瓶恢复成原状,假设瓶内、瓶外均处于标准状况,则所用的钠的质量为_______g。
参考答案:(1)ABD
(2)用滤纸吸干表面的煤油,在玻璃片上用小刀切下绿豆大小的钠粒,并将多余的钠放回试剂瓶中
(3)用铝箔把钠包好后再扎上一些小孔,再用镊子夹住
(4)0.0345
本题解析:
本题难度:一般
2、实验题 实验室需要0.1 mol/L NaOH溶液450 mL根据计算用托盘天平称取NaOH的质量为?g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度?0.1 mol/L
(填“大于”、“等于”或“小于”,下同)。若NaOH在溶解后未冷却到室温,便注入容量瓶内并将洗涤液一并转移到容量瓶,并定容,则所得溶液浓度?0.1 mol/L。
参考答案: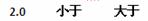
本题解析:略
本题难度:一般
3、实验题 用硝酸氧化淀粉水解的产物(C6H12O6)可制得少量草酸,装置如图A所示(加热、搅拌和仪器固定装置均已略去):已知硝酸氧化淀粉水解液过程中可发生下列反应:

C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6?+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
实验过程如下:
将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,
水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入容器X中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体。
请回答下列问题:
(1)容器X的名称:?。
(2)冷凝管水的进口是?(填a或b);冷凝管冷凝回流的主要物质是 。
(3)实验中若混酸滴加过快,将导致草酸产量下降,其原因是?。
(4)该装置最大的一个缺点是 。
(5)草酸重结晶的减压过滤装置如图B。仪器Y接在水龙头上,其作用是 。
减压过滤的操作有:①将含晶体的溶液倒入漏斗;②将滤纸放入漏斗并用水湿润;③打开水龙头;④关闭水龙头;⑤拆下橡皮管。正确的顺序是 。
(6) 将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:
2MnO4-+ 5H2C2O4 + 6H+ = 2Mn2++ 10CO2↑+ 8H2O
称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1
的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液
颜色由?变为?。滴定前后滴定管中的液面读数如图所
示,则该草酸晶体样品中二水合草酸的质量分数为?。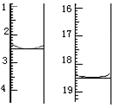
参考答案:(1) 三颈烧瓶…2分
(2) a …1分?硝酸…1分
(3) 温度过高、硝酸浓度过大,导致H2C2O4进一步被氧化?…2分。
(4)缺少尾气处理装置…2分
(5)起抽气作用,使吸滤瓶、安全瓶中的压强减小。…2分 ②③①⑤④…2分
⑹无色?紫红色(或淡紫色)…1分? 84.0%?…2分
本题解析:(1)三颈烧瓶;
(2)冷凝水上进下出,防止受热不均造成冷凝管炸裂;硝酸易挥发,冷凝回流;
(3)温度过高、硝酸浓度过大,导致H2C2O4进一步被氧化,3H2C2O4+2HNO3→6CO2+2NO↑+4H2O;
(4)实验室要注意三禁、八防,防污染,缺少尾气处理装置;
(5)起抽气作用,使吸滤瓶、安全瓶中的压强减小;
⑹滴定终点:溶液颜色有无色变成紫红色,且保持30s不变;KMnO4标准溶液体积16ml,物质的量n=16ml╳0.020 mol·L-1=0.32mmol;根据化学计量系数比,H2C2O4 的物质的量n=0.8mmol,二水合草酸的质量m=0.8mmol╳126g/mol=100.8mg,则该草酸晶体样品中二水合草酸的质量分数为0.1008g/0.12g=84.0%。
本题难度:一般
4、实验题 下图是用来进行乙醇的氧化和氧化产物的检验的实验装置。可供选择的试剂有:氧化铜粉末、乙醇、新制氢氧化钙悬浊液、银氨溶液,溴水、高锰酸钾溶液所需其他仪器任选。(不考虑装置内空气的存在)
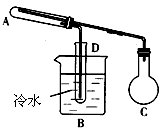
(1)做乙醇氧化实验时,C中应装___________________。
(2)在_________处加热,实验一段时间后A处的实验现象___________________。
(3)在检验乙醇氧化产物时,对B、D的具体操作方法为___________________。其中反应的化学方程式为___________________。
参考答案:(1)酒精
(2)AC;固体由黑变红(管口有液滴)
(3)向D中加适当银氨溶液,给B加热;CH3CHO+2Ag(NH3)2OH CH3COONH4+3NH3+2Ag↓+H2O
CH3COONH4+3NH3+2Ag↓+H2O
本题解析:
本题难度:一般
5、实验题 (12分)
某化学研究性学习小组开展实验探究:在常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清。由此该小组成员对气体的成分提出猜想。
【提出猜想】
猜想1:气体可能为CO2;?猜想2:?;
猜想3:?。
为了验证猜测,该小组设计实验加以探究:
【实验探究】该小组按如图所示装置,将气体从a端通入,则:
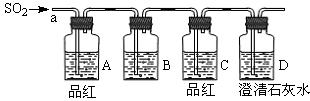
(1)B中应该装入下列?试剂(填编号)
A.NaCl溶液
B.酸性KMnO4溶液
C.盐酸
D.澄清石灰水