微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)现有室温的①HCl? ②H2SO4 ③CH3COOH三种溶液。
(1)若三种酸均为pH=2的溶液,它们的物质的量浓度由大到小的顺序是___________(用序号表示,下同),三种酸溶液各取1mL,分别加水到1000mL,pH最小的是________。
(2)若三种酸均为0.1mol·L-1的溶液,它们的pH由大到小的顺序是________,三种酸溶液各取1mL,分别加水稀释到1000mL,pH最小的是_________。
参考答案:(共8分,每空2分)(1)③①②;③?(2)③①②;②
本题解析:(1)盐酸是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,所以在pH相等的条件下,它们的物质的量浓度由大到小的顺序是③①②。稀释促进醋酸的电离,所以醋酸的pH变化最小,即答案选③。
(2)在浓度相同的条件下,弱酸的pH大于强酸的,即pH由大到小的顺序是③①②。由于稀释的浓度还都是相同的,所以pH最小的硫酸的,即答案选②。
本题难度:一般
2、选择题 一定温度下,甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中c(OH—)
之比为
A.大于10
B.小于10
C.等于10
D.无法确定
参考答案:B
本题解析:弱电解质溶液中,弱电解质的浓度越大,其电离程度越小,浓度越小,其电离程度越大,据此可以判断。一水合氨是弱电解质,在溶液里存在电离平衡,氨水的浓度越大,一水合氨的电离程度越小,浓度越小,一水合氨的电离程度越大。甲瓶氨水的浓度是乙瓶氨水的浓度的10倍,由弱电解质的浓度越小,电离程度越大可知,甲瓶氨水的电离程度比乙瓶氨水的电离程度小,所以甲、乙两瓶氨水中c(OH—)之比小于10,答案选B。
本题难度:一般
3、填空题 某一元弱酸(用HA表示)在水中的电离方程式是:HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向________(填“正”、“逆”)反应方向移动,理由是______________________________________________________。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向________(填“正”、“逆”、“不移动”)反应方向移动,溶液中c(A-)将________(填“增大”、“减小”或“不变”,下同),溶液中c(OH-)将________。
参考答案:(1)逆 c(A-)增大,平衡向减小c(A-)的方向即逆反应方向移动 (2)正 减小 增大
本题解析:(1)HA在水中的电离方程式为HA H++A-,所以向溶液中加入适量NaA固体,溶液中的A-浓度增大,平衡将向逆反应方向移动;
H++A-,所以向溶液中加入适量NaA固体,溶液中的A-浓度增大,平衡将向逆反应方向移动;
(2)若向溶液中加入适量NaCl溶液,以上平衡将向正反应方向移动,因溶液中c(A-)将减小,而溶液中c(OH-)将增大;
本题难度:一般
4、选择题 电解质溶液的酸度(用AG表示)定义为c(H+)与 C(OH-)比值的对数,即AG=lg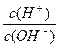 。常温下,下列各组离子在AG=12的无色溶液中能大量共存的是(? )
。常温下,下列各组离子在AG=12的无色溶液中能大量共存的是(? )
A.Mg2+、Ca2+、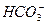 、Cl-
、Cl-
B.K+、I-、 、Br-
、Br-
C.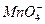 、Ca2+、Cl-、
、Ca2+、Cl-、
D.Na+、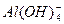 、Cl-、
、Cl-、
参考答案:B
本题解析:由AG=12,可推出溶液中c(H+)=1×10-1 mol·L-1,溶液呈酸性。选项A中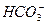 不能与H+大量共存;选项C中
不能与H+大量共存;选项C中 是有颜色的离子;D项中
是有颜色的离子;D项中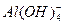 与H+不能大量共存。
与H+不能大量共存。
本题难度:简单
5、填空题 (12分)已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
①
| HF
| Ka=6.8×10-4 mol?L-1
|
②
| CH3COOH
| Ka=1.7×10-5 mol?L-1
|
③
| HCN
| Ka=6.2×10-10 mol?L-1
|
④
| H2CO3
| Ka1=4.4×10-7mol?L-1
Ka2=4.7×10-11 mol?L-1
|
根据上述数据,回答下列问题:
(1)四种酸中酸性最强的是_____________,四种酸中酸性最弱的是_____________。
(2)写出H2CO3电离方程式是?、?。
(3)写出反应的方程式:足量的氢氟酸与碳酸钠溶液混合:___________?______,
足量的CO2通入NaCN溶液中:_________?_____。
参考答案:(1)氢氟酸,? HCN?
(2)H2CO3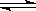 HCO3—+H+,? HCO3—
HCO3—+H+,? HCO3—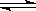 CO32—+H+
CO32—+H+
( 3)2HF+Na2CO3=2NaF+H2O+CO2↑,? NaCN+H2O+CO2= HCN+NaHCO3
本题解析:(1)电离常数越大,相应酸的酸性越强,所以根据电离常数可知,酸性最强的是氢氟酸,而最弱的是HCN。
(2)碳酸是二元弱酸,电离是分步进行的,所以电离方程式依次是
H2CO3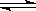 HCO3—+H+、HCO3—
HCO3—+H+、HCO3—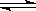 CO32—+H+。
CO32—+H+。
(3)由于氢氟酸的电离常数大于碳酸的电离常数,所以根据较强酸制取较弱的酸可知,反应的方程式是2HF+Na2CO3=2NaF+H2O+CO2↑;由于碳酸的第一步电离常数大于HCN的,但第二步小于HCN的,所以足量的CO2通入NaCN溶液中反应方程式是NaCN+H2O+CO2= HCN+NaHCO3。
本题难度:一般