微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物有着广泛的应用。
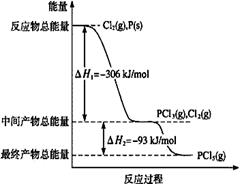
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
请回答问题:
①PCl5分解成PCl3和Cl2的热化学方程式是 。
②P和Cl2分两步反应生成1 mol PCl5的△H3= 。
(2)PCl5分解成PCl3和Cl2的反应是可逆反应。T℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过250 s达到平衡。反应过程中测定的部分数据见下表:
t / s
| 0
| 50
| 150
| 250
| 350
|
n(PCl3) / mol
| 0
| 0.16
| 0.19
| 0.20
| 0.20
|
①反应在50~150s 内的平均速率v(PCl3)= 。
②试计算该温度下反应的平衡常数(写出计算过程,保留2位有效数字)
(3)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示。

①为获得较纯的Na2HPO4,pH应控制在 ;pH=6时,溶液中主要含磷物种浓度大小关系为: 。
②Na2HPO4溶液呈碱性,加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从离子平衡角度分析) 。
参考答案:(1)①PCl5(g)=PCl3(g)+Cl2(g)△H=+93kJ/mol(2分,方程式1分,△H的表示1分,化学式、状态错误0分;+、焓变数值、单位错漏合扣1分;计量数用分数表示与焓变相匹配也给分)
②-399 kJ/mol(2分,单位错漏扣1分)
(2)①1.5×10-4mol/(L·s) 或0.00015 mol/(L·s)(2分,单位错漏扣1分)
②2.5×10-2 mol/L或0.025mol/L
(3)①9~10.5(2分,介于此区间或区间内的某一点)
c(H2PO4-)>c(HPO42-) (2分)
②Na2HPO4溶液中存在电离平衡,HPO42-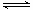 H++PO43-(1分),加入CaCl2溶液,Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大,溶液显酸性(1分)。(合理即给分)
H++PO43-(1分),加入CaCl2溶液,Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大,溶液显酸性(1分)。(合理即给分)
本题解析:(1)①题干中特别注明图中物质转化的焓变是生成1mol产物的数据,因此PCl5分解成PCl3和Cl2是吸热反应,其热化学方程式为:PCl5(g)=PCl3(g)+Cl2(g)△H=+93kJ/mol;
②计算P和Cl2分两步反应生成1 mol PCl5 的焓变,根据盖斯定律反应的焓变与过程无关,只需将图像中两部分的焓变相加即可,所以△H3=-399 kJ/mol。
(2)①计算反应在50~150s 内的用PCl3表示的反应速率,只需把数据代入公式,因此有v(PCl3)=△C/△t=(0.19-0.16)mol/(2L×100s)= 1.5×10-4mol/(L·s);
② PCl5(g) = PCl3(g)+Cl2(g)
起始浓度(mol/L) 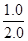 =0.50 0 0
=0.50 0 0
转化浓度(mol/L) 0.10 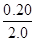 =0.10 0.10
=0.10 0.10
平衡浓度(mol/L) 0.40 0.10 0.10 (1分)
K= 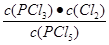 =
= 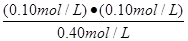 = 2.5×10-2 mol/L或0.025mol/L
= 2.5×10-2 mol/L或0.025mol/L
(3)此题要学会认真读图,该图表示的是H3PO4与不断加入的NaOH反应,氢氧化钠量不断增大使溶液pH值不断增大时,溶液中各含磷物种的百分比。每个含磷物种在一定的PH范围内都有百分含量极大和极小的情况,而两条线交叉部分表示的则是2种含磷物种同时存在的情况。
①要获得叫纯净的Na2HPO4,则通过图像找到PH值在9~10.5的范围内,HPO42- 的百分含量接近百分百,所以控制的PH只要在这个范围内,都可以获得较纯净的Na2HPO4 。
②Na2HPO4是弱酸酸式盐,HPO42-存在电离和水解两个平衡,由于溶液呈碱性,可以看出水解强于电离。但是该盐溶液加入氯化钙后,溶液呈酸性,因此可以推测加入的氯化钙一定改变了电离平衡,使之不断产生出氢离子,使溶液呈酸性。所以结合本题的题干“磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在”,可以解释平衡的移动为:Na2HPO4溶液中存在电离平衡,HPO42-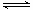 H++PO43-,加入CaCl2溶液,Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大,溶液显酸性。
H++PO43-,加入CaCl2溶液,Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大,溶液显酸性。
考点:本题考查的是反应原理的知识,侧重于化学与反应能量的关系、反应速率和平衡常数计算、平衡移动原理解释等方面的考查。
本题难度:困难
2、选择题 下列事实一定能说明HF是弱酸的是 ?①常温下NaF溶液的pH大于7 ②用HF溶液做导电性实验,灯泡很暗 ?③HF与NaCl不能发生反应 ④常温下0.1?mol·L-1的HF溶液的pH为2.3 ⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
[? ]
A.①④?
B.②③⑤?
C.③④⑥?
D.①②④
参考答案:A
本题解析:
本题难度:一般
3、选择题 pH=2的A.B两种酸溶液各lmL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是
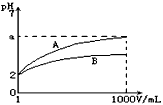
[? ]
A.A.B两种酸溶液物质的量浓度一定相等
B.稀释后A酸溶液的酸性比B酸溶液强
C.a=5时,A是强酸,B是弱酸
D.若A.B都是弱酸,则5≥a>2
参考答案:C
本题解析:
本题难度:一般
4、填空题 为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:
0.010 mol·L-1氨水、0.1 mol·L-1 NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确? (填“正确”或“不正确”),并说明理由 。
(2)乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b应满足什么关系? 。
(3)丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞试液,显粉红色,再加入少量NH4Cl晶体,溶液颜色变 (填“深”或“浅”)。你认为这一方法能否证明NH3·H2O是弱电解质? (填“能”或“否”),并说明原因 。
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3·H2O是弱电解质: 。
参考答案:(1)正确 若是强电解质,则0.010 mol·L-1氨水中c(OH-)应为0.010 mol·L-1,pH=12
(2)a-2<b<a
(3)浅 能 0.010 mol·L-1氨水(滴有酚酞试液)中加入氯化铵晶体后颜色变浅,有两种可能:一是氯化铵在水溶液中电离出的NH4+水解使溶液显酸性,加入氨水中使其pH降低;二是NH4+使NH3·H2O的电离平衡NH3·H2O NH4++OH-逆向移动,从而使溶液的pH降低。这两种可能均可证明NH3·H2O是弱电解质
NH4++OH-逆向移动,从而使溶液的pH降低。这两种可能均可证明NH3·H2O是弱电解质
(4)取一张pH试纸,再用玻璃棒蘸取0.1 mol·L-1 NH4Cl溶液,滴在pH试纸上,显色后跟标准比色卡比较测出pH,pH<7(方案合理即可)
本题解析:(1)若NH3·H2O是强电解质,则0.010 mol·L-1氨水中c(OH-)应为0.010 mol·L-1,pH=12。用pH试纸测出0.010 mol·L-1氨水的pH为10,说明NH3·H2O没有完全电离,应为弱电解质。
(2)若NH3·H2O是强电解质,用蒸馏水稀释至1 000 mL,其pH=a-2。因为NH3·H2O是弱电解质,不能完全电离,a、b应满足a-2<b<a。
(3)向0.010 mol·L-1氨水中加入少量NH4Cl晶体,有两种可能:一是氯化铵在水溶液中电离出的NH4+水解使溶液显酸性,加入氨水中使其pH降低;二是NH4+使NH3·H2O的电离平衡NH3·H2O NH4++OH-逆向移动,从而使溶液的pH降低。这两种可能均会使溶液颜色变浅,可证明NH3·H2O是弱电解质。
NH4++OH-逆向移动,从而使溶液的pH降低。这两种可能均会使溶液颜色变浅,可证明NH3·H2O是弱电解质。
(4)NH4Cl为强酸弱碱盐,只需检验NH4Cl溶液的酸碱性,即可证明NH3·H2O是弱电解质,还是强电解质。
本题难度:一般
5、选择题 根据下表信息,下列判断正确的是
酸
| 电离常数(常温下)
|
CH3COOH
| Ki=1.8×10-5
|
H2CO3
| Ki1=4.3×l0-7, Ki2= 5.6×10-11
|
H2S
| Ki1= 9.1×10-8, Ki2= 1.1×10-12
|
A.0.10mol/L的下列各溶液pH:Na2S<Na2CO3
B.HCO3-+CH3COOH→H2O+CO2↑+CH3COO-
C.硫化钠溶液可以与碳酸氢钠溶液反应
D.pH相同的CH3COOH、H2CO3、H2S,溶液浓度依次减小
参考答案:BC
本题解析:A.电离常数越大酸性越强,则根据电离平衡常数可知酸性是碳酸氢钠大于硫氢化钠,酸性越弱,酸根越容易水解,溶液的碱性越强,则0.10mol/L的下列各溶液pH:Na2S>Na2CO3,A错误;B.醋酸的酸性强于碳酸,则根据较强酸制备较弱酸可知HCO3-+CH3COOH→H2O+CO2↑+CH3COO-,B正确;C.酸性是碳酸氢钠大于硫氢化钠,则硫化钠溶液可以与碳酸氢钠溶液反应生成硫氢化钠和碳酸钠,C正确;D.酸性是CH3COOH>H2CO3>H2S,则pH相同的CH3COOH、H2CO3、H2S,溶液浓度依次增大,D错误,答案选BC。
考点:考查电离平衡常数的应用
本题难度:一般