微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在0.1 mol·L-1的HCN溶液中存在如下电离平衡HCN H++CN-,对该平衡,下列叙述正确的是( )
H++CN-,对该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡向正反应方向移动
B.加水,平衡向逆反应方向移动
C.滴加少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减少
D.加入少量NaCN固体,平衡向正反应方向移动
参考答案:A
本题解析:加NaOH固体,OH-+H+ H2O,平衡正向移动,A项正确;加水平衡正向移动,B项错误;滴加少量0.1 mol·L-1 HCl溶液,c(H+)增大,C项错误;加入少量NaCN固体,c(CN-)增大,平衡逆向移动。
H2O,平衡正向移动,A项正确;加水平衡正向移动,B项错误;滴加少量0.1 mol·L-1 HCl溶液,c(H+)增大,C项错误;加入少量NaCN固体,c(CN-)增大,平衡逆向移动。
本题难度:一般
2、填空题 (1)有等体积、等pH的Ba(OH)2和NH3·H2O两种溶液,用等浓度的盐酸来滴定,恰好中和时,用去酸的体积分别为V1、V2,则有:V1?V2(填“>”、“<”或“=”)
(2)常温下,等体积、等pH的醋酸和硫酸溶液中:c(CH3COO-)??c(SO 42-)填
(填“>”、“<”或“=”)
(3)在AgCl悬浊液中加入过量KI溶液,白色沉淀转化为黄色沉淀。加入过量KI溶液充分反应后,溶液中Ksp(AgCl)?(填“增大”、“减小”或“不变”)
(4)在0.10mol·L-1氨水中,加入少量NH4Cl晶体后,则 NH3·H2O的电离程度?(填“增大”、“减小”或“不变”)
参考答案:(1) <?(2) >?(3) 不变?(4)减小
本题解析:(1)由于氨水是弱电解质,所以在PH值相同的情况下。氨水消耗酸的体积比较大。(2)由于醋酸是属于弱酸,所以在PH值相同的情况下,醋酸的浓度大于硫酸。(3)溶解平 衡常数只与温度有关。所以Ksp(AgCl)不变。(4)加入氯化铵之后,铵根离子增加。反应向氨水的电离的反方向移动,所以氨水的电离程度减小
本题难度:一般
3、填空题 I,已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸K =1.75×10-5
碳酸K1=4. 30×10-7 K2=5.61×10-11
亚硫酸K1=1.54×10-2 K2=1.02×10-2
(1)写出碳酸的第一级电离平衡常数的表达式:K1=___。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱:____>____>___ 。
(3)若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是___(填序号)。
A.c(CH3COO -)
B.c(H+)
C.醋酸电离平衡常数
D.醋酸的电离程度
Ⅱ,某化工,一废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01 mol.L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:

(4)你认为往废水中投入____(填字母序号),沉淀效果最好。
A.NaOH
B.Na2S
C.KI
D.Ca(OH)2
(5)如果用食盐处理只含有重金属Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(密度约为 1 g.mL-1)。若环境要求排放标准为c(Ag+)低于1.0×10-8 mol.L-1,问该工厂处理后的废水中c(Ag+)= _____[已知:Ksp(AgCl) =1.8×10-10]。
参考答案:(1)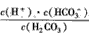
(2)H2CO3 ;HSO3- ;HCO3-
(3)AD
(4)B
(5)9×10 -9 mol . L-1
本题解析:
本题难度:一般
4、简答题 25℃时,几种弱酸溶液的pH如下表所示:
| 弱酸 | CH3COOH | H2SO3 | HCN
物质的量浓度mol/L
0.01
0.01
0.01
pH
3.4
2.3
5.6
|

(1)25℃时,Na2SO3溶液的pH______(填“>”、“<”“或“=”)7,其原因是______(用离子方程式表示).
(2)图1是常温下,相同pH的CH3COOH和HCN溶液分别加水稀释时溶液的pH随溶液体积变化的曲线.
①图1中曲线______(填“Ⅰ”或“Ⅱ”)表示加水稀释HCN溶液时pH的变化.
②下列操作能使CH3COOH的电离程度与同时增大的是______.
A.加水稀释溶液? B.升高溶液温度? C.加入少量NaHSO4固体? D.加入少量CH3COONa固体
③在图2中分别画出常温下CH3COONa溶液和NaCN溶液中由水电离出的c(OH-)与其盐浓度的变化曲线.
(3)常温下,物质的量浓度相同的CH3COONa溶液和NaCN溶液中,CH3COONa溶液中各离子浓度之和______(填“>”、“<”或“=”)NaCN溶液中各离子浓度之和.
(4)已知:HCN(aq)
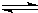
H+(aq)+CN-(aq)△H=+43.5kJ?mol-1
H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ?mol-1则NaCN在溶液中发生水解的热化学方程式:
CN-(aq)+H2O(1)
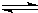
?HCN(aq)+OH-(aq)的△H=______.该反应25℃时的平衡常数K=______.
(需填具体数值,已知10-5.6=2.5×10-6)
参考答案:(1)25℃时,0.01mol/L亚硫酸的pH=2.3,则亚硫酸为弱酸,即亚硫酸钠为强碱弱酸盐,由SO32-+H2O

HSO3-+OH-可知溶液显碱性,pH>7,
故答案为:>;SO32-+H2O

HSO3-+OH-;
(2)①由表格中的数据可知,相同浓度的CH3COOH和HCN溶液,HCN的pH大,则HCN的酸性更弱,相同pH的CH3COOH和HCN溶液分别加水稀释时,醋酸的氢离子
浓度变化大于HCN中氢离子的浓度变化,则醋酸的pH变化大,所以曲线Ⅱ表示加水稀释HCN溶液时pH的变化,故答案为:Ⅱ;
②由CH3COOH

H++CH3COO-,加水稀释,促进电离,电离平衡正向移动,电离程度增大,c(H+)c(CH3COOH)增大,故A正确;
因弱电解质的电离是吸热的,则升高温度,电离平衡正向移动,电离程度增大,c(H+)c(CH3COOH)增大,故B正确;
加入少量NaHSO4固体,H+的浓度增大,电离平衡逆向移动,电离程度减小,故C错误;
加入少量CH3COONa固体,CH3COO-的浓度增大,电离平衡逆向移动,电离程度减小,故C错误;
故答案为:AB;
③由表格中的数据可知,酸性CH3COOH>HCN,CH3COONa溶液和NaCN溶液中都水解生成OH-,但相同浓度的盐时,NaCN溶液水解生成的OH-离子浓度大,
且盐的浓度越大,水解生成的OH-离子浓度也就越大,故答案为:
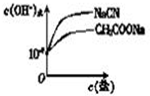
;
(3)物质的量浓度相同的CH3COONa溶液和NaCN溶液中,由电荷守恒可知CH3COONa溶液中存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),
NaCN溶液中存在c(Na+)+c(H+)=c(CN-)+c(OH-),则两溶液中的离子浓度之和的比较即为2c(Na+)+2c(H+)的比较,
等物质的量浓度时,NaCN溶液水解生成的OH-离子浓度大,则2c(H+)就小,所以CH3COONa溶液中各离子浓度之和大,故答案为:>;
(4)HCN(aq)
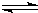
H+(aq)+CN-(aq)△H=+43.5kJ?mol-1①,
H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ?mol-1②,
由盖斯定律可知反应CN-(aq)+H2O(1)
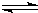
?HCN(aq)+OH-(aq)可由-①+(-②)得到,则反应热
△H═-(+43.5kJ?mol-1)+57.3kJ?mol-1=+13.8?kJ/mol,K=1Ka×Kw=0.012.5×10-6×2.5×10-6×10-14=1.6×10-5,
故答案为:+13.8?kJ/mol;1.6×10-5.
本题解析:
本题难度:一般
5、选择题 对pH值相同的盐酸和醋酸两种溶液的说法正确的是( )
A.中和碱的能力相同
B.盐酸和醋酸的物质的量浓度相同
C.OH-的物质的量浓度相同
D.H+的物质的量浓度不同
参考答案:A.中和碱的能力与酸的物质的量成正比,酸的物质的量未知,无法判断中和碱能力强弱,故A错误;
B.醋酸是强电解质,氯化氢是强电解质,pH相等的醋酸和盐酸,醋酸的浓度大于盐酸,故B错误;
C.根据c(OH-)=Kwc(H+)知,pH相等的醋酸和盐酸中氢离子浓度相等,温度相等,水的离子积常数相等,则氢氧根质量浓度相等,故C正确;
D.根据c(H+)=10-pH 知,pH相等的醋酸和盐酸中,氢离子浓度相等,故D错误;
故选C.
本题解析:
本题难度:一般