微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)硝酸是重要的工业原料。
①可用铝制容器存放浓硝酸的理由是 ;
②某硝酸厂处理尾气NO2的方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g) + O2(g) = 2H2O(g) △H=-483 kJ·moL-1
N2(g) + 2O2(g) = 2NO2(g) △H=+68 kJ·moL-1
则H2还原NO2生成水蒸气的热化学方程式是:
。
(2)某研究小组以CaCl2和H2为原料制备+1价Ca的化合物,产物中只有甲和乙两种化合物。研究发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为 ,甲与水反应可得H2,其化学方程式是: ;
②写出由CaCl2通过化合反应制备CaCl的化学方程式: 。
参考答案:(1)①常温下,浓硝酸可使铝表面形成致密的氧化膜而钝化(2分)
②4H2(g) + 2NO2(g)=N2(g) + 4H2O(g) △H=-1034 kJ·moL-1(3分)
(2)①HCl(1分) 2CaHCl + 2H2O=CaCl2 + Ca(OH)2 + 2H2↑(3分)
②Ca + CaCl2=2CaCl(2分)
本题解析:(1)①常温下,铝在浓硝酸中钝化,表面形成致密的氧化膜而隔离铝和浓硝酸,所以可用铝制容器存放浓硝酸。
②首先携程H2与NO2反应的化学方程式并注明状态,然后根据盖斯定律求出?H,?H=2?H1-?H2=-1034 kJ·moL-1,可写出热化学方程式:4H2(g) + 2NO2(g)=N2(g) + 4H2O(g) △H=-1034 kJ·moL-1
(2)①反应物为CaCl2和H2,根据元素守恒,生成物乙显酸性,则乙为:HCl;化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,则H元素的质量分数为:1—52.29%—46.41%=1.3%,根据元素质量比可得该化合物的化学式为:CaHCl,与水反应生成H2的反应为:2CaHCl + 2H2O=CaCl2 + Ca(OH)2 + 2H2↑
②Ca具有强还原性,可与CaCl2反应生成CaCl,化学方程式为:Ca + CaCl2=2CaCl
考点:本题考查物质的保存、热化学方程式和化学方程式的书写、物质的推断。
本题难度:一般
2、填空题 (10分)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ· g-1、10kJ·g-1和23kJ·g-1。请回答下列问题:
(1)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_ ______;
(2)在直接以甲醇为燃料电池中,电解质溶液为碱性,负极的反应式为_____ , 总反应式 。
(3)在350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒容器中,充分反应生成甲醇蒸汽和水蒸气达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;若350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒压器中,充分反应达到平衡后,若CO2转化率为b,则a b(用“>、=、<”表示)
参考答案:(10分)(1)CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H =-456KJ/mol
(2)CH3OH+8OH- -6e-=CO32-+6H2O ; 2CH3OH+3O2+4OH-=2CO32-+6H2O。
(3)1-a,<
本题解析:(1)H2(g)、CO(g)和CH3OH(l)的燃烧热分别为:286kJ· mol-1、280kJ· mol-1、713kJ· mol-1;由盖斯定律求解:
2CO(g) + O2(g) =2CO2(g) △H=-560KJ mol-1②
CH3OH(l)+3/2 O2(g)=CO2(g)+2 H2O(l) △H=-736kJ·mol-1③
将③-②/2可知:CH3OH(l)+ O2(g)="CO(g)+2" H2O(l) △H=-456kJ·mol-1
(2)总反应:2CH4O + 3O2 + 4OH—= 2CO32- + 6H2O
负极:CH3OH+8OH- -6e-=CO32-+6H2O 正极:O2 + 4e
本题难度:困难
3、简答题 化学在能源开发与利用中起着十分重要的作用.
(1)蕴藏在海底的“可燃冰”是高压下形成的外观酷似冰的甲烷水合物.我国南海海底有丰富的“可燃冰”资源.取365g分子式为CH4?9H2O的“可燃冰”,将其释放的甲烷完全燃烧生成CO2和H2O(l),可放出1780.6kJ的热量,则甲烷燃烧的热化学方程式为______.

(2)甲醇是重要的基础化工原料,又是一种新型的燃料,制取甲醇的传统方法是采用CuO-ZnO/γ-Al2O3为催化剂,合成反应为:CO+2H2
CH3OH.生产中一些工艺参数如图所示.该反应为______(填“吸热”或“放热”)反应.说明你作出判断的依据______.
最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的正极反应式为______.电池工作时,固体电解质里的O2-向______极推动.
参考答案:(1)365g中甲烷的物质的量为365g178g/mol=2mol,其完全燃烧生成CO2和H2O(l),可放出1780.6kJ的热量,则1mol甲烷其完全燃烧放出热量890.3 kJ,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ?mol-1,故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ?mol-1;
(2)由图可知:论在何种压强下,都是温度越高,CO的转化率越小,说明正反应放热,
故答案为:放热;由图知,不论在何种压强下,都是温度越高,CO的转化率越小;
(3)根据原电池原理,正极O2得到电子生成负极O2-:O2+4e-=2O2-,电池中阴离子向负极移动,故答案为:O2+4e-=2O2-;负.
本题解析:
本题难度:一般
4、简答题 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?

?CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?

?CH3OH(g)+H2O(g)△H2
①在以上制备甲醇的两个反应中:反应I优于反应II,原因为______.
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数的数值:
| 温度 | 250℃ | 300℃ | 350℃
K
2.041
0.270
0.012
|
I、在一密闭容器中发生反应Ⅰ并达到平衡后,保持其他条件不变,对容器升温,此反应的化学反应平衡应______移动(填“正向”、“逆向”、“不”).
II、某温度下,将1mol?CO和4molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.1mol/L,则CO的转化率为______,此时的温度______250℃(填“>”、“<”、“=”)
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H1=-Q1kJ/mol
②2CO?(g)+O2(g)=2CO2(g)△H2=-Q2?kJ/mol③H2O(g)=H2O(l)△H3=-Q3?kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:______
(3)某同学依据甲醇燃烧的反应原理,设计如图所示的电池装置,工作一段时间后,测得溶液的pH将______填“升高”、“降低”、“不变”),该燃料电池负极反应的离子方程式为:______.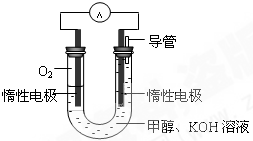
参考答案:(1)反应I中反应物完全转化,子利用率为100%,符合“原子经济性”的原则,故答案为:①反应I符合“原子经济性”的原则即原子利用率为100%;
②温度升高化学平衡常数减小,说明生成物减少,反应物增多,故反应向逆向移动,反应放热;达到平衡时,反应的CO的物质的量为:1mol-2L×0.2moL/L=0.8mol,转化率为0.81×100%=80%,此时平衡常数为k=c(CH3OH)c(CO)×c2(H2)=0.4mol/L0.1mol/L×(0.2mol/L)2=100(mol/L)-3,温度小于250℃,
故答案为:I:逆向;II:80%;<;
(2)根据盖斯定律计算,2×③+12×②-12×①可得甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式
CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=(2Q3+0.5Q2-0.5Q1)kJ/mol,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=(2Q3+0.5Q2-0.5Q1)kJ/mol;
(3)该燃料电池的正极反应为:02+4e-+2H2O═4OH-,负极反应为:CH3OH-6e-+8OH-═CO32-+6H2O,总反应为:2CH3OH+302+4OH-═2CO32-+6H2O,根据反应式可知工作一段时间后,测得溶液的pH将降低,故答案为:降低;CH3OH-6e-+8OH-═CO32-+6H2O.
本题解析:
本题难度:一般
5、计算题 (8分)将0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量。
(1)写出上述反应的热化学方程式。
(2)已知H2O(l)转化为H2O(g)的△H=44KJ.mol_1,试计算11.2L(标准状况下)气态乙硼烷完全燃烧生成气态水时放出的热量。(请写出计算过程)
参考答案:(1)B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=-2165kJ.mol-1
(2)1016.5kJ
本题解析:(1)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,反应的热化学方程式为
B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)
(2)①B2H6(g)+3O2(g)
本题难度:一般