微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
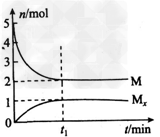
1、选择题 E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)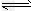 Mx(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法正确的是
Mx(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法正确的是
[? ]
A.该反应的化学方程式是2HF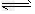 (HF)2
(HF)2
B.平衡时混合气体的平均摩尔质量是33.3
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时, M的转化率将增大
D.M的水溶液酸性比同主族下一周期元素的气态氢化物的水溶液酸性强
参考答案:C
本题解析:
本题难度:一般
2、填空题 已知反应:aA(g)+bB(g)?cC(g)
根据图形推测:
(1)P1______P2?(?填>或<)
(2)a+b______c?(?填>或<)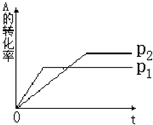
参考答案:(1)由图象可知P1曲线反应速率较大,说明P1压强较大,故答案为:>;
(2)压强增大,A的转化率减小,说明增大压强,平衡向逆反应方向移动,则有a+b<c,故答案为:<.
本题解析:
本题难度:一般
3、选择题 恒温条件下,把NO2装入带活塞的密闭容器中,当反应2NO2?N2O4达到平衡后,下列叙述正确的是( )
A.恒容时,再充入一定量的N2O4,则NO2的体积分数增加
B.慢慢压缩容器,平衡向右移动,混合气体的颜色一定会变浅
C.体积减半时,压强增大,但小于原来的2倍
D.体积增大时,平衡向右移动,混合气体密度减少
参考答案:A、再充入一定量的N2O4所到达平衡状态,等效为在原平衡的基础上增大压强,平衡向正反应移动,NO2的体积分数减小,故A错误;
B、压缩容器,压强增大,平衡向体积减小的方向移动,平衡移动的结果降低浓度增大,但不会消除浓度增大,达新平衡NO2浓度增大,气体颜色变深,故B错误;
C、体积减半时,若平衡不移动,压强变为原来2倍,压强增大,平衡向正反应移动,故压强小于原来的2倍,故C正确;
D、体积增大时,压强减小,平衡向体积增大的方向移动,即向正反应移动,混合气体的质量不变,体积增大混合气体密度减小,故D错误;
故选C.
本题解析:
本题难度:简单
4、填空题 如下图,甲、乙、丙分别表示在不同条件下可逆反应:A(g)+B(g) xC(g)的生成物 C在反应混合物中的百分含量(C%)和反应时间(t)的关系。?
xC(g)的生成物 C在反应混合物中的百分含量(C%)和反应时间(t)的关系。?
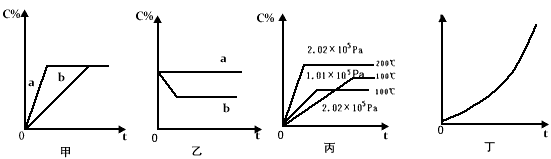
(1)若甲图中两条曲线分别代表有催化剂和无催化剂的情况,则__________曲线表示无催化剂时的情况,速率:a ________b(填:大于、小于或等于)
(2)若乙图表示反应达到平衡后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He气后的情况,则__________曲线表示恒温恒容的情况,此时该恒温恒容中____________C% (填:变大、变小或不变)
(3)根据丙图可以判断该可逆反应的正反应是___________热反应(填:放热、吸热),计量数x的值是 ____________;
(4)丁图表示在某固定容器的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度(T)的变化情况,根据你的理解,丁图的纵坐标可以是_____________,[填:①C% ②A的转化率 ③B的转化率 ④压强 ⑤c(A) ⑥c(B)];升温平衡移动的方向为________________ 。(填:左移或右移)
参考答案:(1)b ;大于
(2)a ;不变
(3)吸 ;大于2(或大于等于3)
(4)①②③④ ;右
本题解析:
本题难度:一般
5、选择题 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:


 下列说法错误的是:
下列说法错误的是:



A.反应达到平衡时,X的转化率为50%

B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600

C.增大压强使平衡向生成Z的方向移动,平衡常数增大

D.改变温度可以改变此反应的平衡常数
参考答案:C
本题解析:题中有一明显的错误,就是C选项中平衡常数增大,增大压强不可能使平衡常数增大。其他选项均为平衡中的基础计算和基础知识,关键是根据表中数据(0.1-0.05)∶(0.2-0.05) ∶(0.1-0)=1∶3∶2可推导出:X+3Y 2Z。
2Z。
本题难度:一般