微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 二氧化氮(NO2)是一种具有高度活性的气态物质,NO2与Na2O2均具有较强的氧化性,某研究性学习小组对二者能否发生反应进行探究。
【实验】
下列关于实验室制备NO2的说法正确的是_______
a.实验室常用铜和浓硝酸反应制取二氧化氮
b.二氧化氮常用向下排空气法收集
c.二氧化氮易溶于水,尾气可用水吸收.
d.用注射器收集的二氧化氮,压缩后颜色变浅
e.实验后容器中残留液需用碱液处理
【提出假设】
假设一:NO2与Na2O2二者不反应;
假设二:NO2能被Na2O2氧化;
假设三:?
【查阅文献】
NO2在反应中能生成HNO3和HNO2;HNO2旣有氧化性,又有还原性,能被强氧化剂如KMnO4氧化。
【设计实验】
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设?不成立。
(2)若假设二成立,反应的化学方程式是?。
(3)为验证假设二是否成立,该小组同学做了如下定性实验研究,请完成下表内容。
实验步骤
(不要求写具体操作过程,仪器任选)
| 预期的实验现象及结论
|
取适量的白色固体置于试管中,…………
| ?
|
?
【定量分析】
若实验前该小组同学用托盘天平称量过氧化钠的质量为3.9g,充分反应后白色固体质量为8.4g,该小组同学得出假设2不成立的结论。你是否同意他们的结论,并简述理由:?
参考答案:(共13分)
【实验】a e(2分)?
【提出假设】假设三:NO2能被Na2O2还原(2分)
【设计实验】 (1)一(1分)
(2)2NO2 + Na2O2 = 2NaNO3(2分,不配平不得分)
(3)(4分)
实验步骤(不要求写具体操作过程)
预期的实验现象及结论
取适量的白色固体置于试管中,加蒸馏水溶解,再滴加稀硫酸酸化,最后滴加高锰酸钾溶液。
若高锰酸钾溶液不褪色,则假设2成立;若高锰酸钾溶液褪色,则假设2不成立。(其他合理答案也可)
?
(4)(2分)不同意。若3.9 g过氧化钠全部氧化二氧化氮,生成NaNO3的质量应该为8.5 g,而现在测量的质量为8.4 g,质量相差不大,在托盘天平称量的误差范围之内,这完全有可能为实验误差引起。
(同意。若3.9 g过氧化钠全部氧化二氧化氮,生成的NaNO3的质量应该为8.5 g,而现在测量的质量为8.4 g<8.5 g。注:本题为开放性答案,其它合理答案也可)
本题解析:
【实验】考查NO2的制备,a、Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,正确;b、NO2能与水发生反应,故不能使用排水法收集,错误;c、溶于水后生成NO,同样是污染,错误;d、压缩后虽有部分转化为N2O4,但NO2的浓度增大,颜色加深,错误;e、残液为酸性,故用碱处理,正确。
【提出假设】根据情况,不反应、反应被氧化,另外为反应被还原;
【设计实验】
(1)用淡黄色变为白色,说明过氧化钠反应,假设一错误
(2)假设二成立,NO2被Na2O2氧化,即氮的化合价升高从+4到+5,O从-1到-2,然后配平即得到答案。
(3)关键是对产物的检验,硝酸根的检验方法。
本题难度:一般
2、填空题 配平下列氧化还原反应方程式,标出电子转移方向和数目,并完成下列问题:
(1)Cl2+KOH——KCl+KClO3+H2O
氧化剂是__________,还原剂是__________,两者的质量之比__________。
(2)在KClO3+HCl——KCl+Cl2↑+H2O的反应中,盐酸的作用是__________,被还原的元素是__________,当反应中有3 mol电子转移时,产生的Cl2在标准状况下体积是__________。
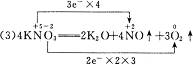
(3)在KNO3 K2O+NO↑+O2↑反应中,氧化产物是___________,还原产物是___________,两者的物质的量之比是___________。
K2O+NO↑+O2↑反应中,氧化产物是___________,还原产物是___________,两者的物质的量之比是___________。
参考答案:(1)Cl2? Cl2? 5∶1
(2)还原剂、酸性? Cl? 40.32 L
(3)O2? N2? 3∶4
本题解析:

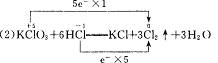
本题难度:简单
3、选择题 下列反应属于非氧化还原反应的是
A.2Al+Fe2O3 2Fe+Al2O3
2Fe+Al2O3
B.2Mg+CO2 2MgO+C
2MgO+C
C.N2+3H2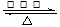 2NH3
2NH3
D.SiO2+CaO CaSiO3
CaSiO3
参考答案:D
本题解析:非氧化还原反应即化合价没有发生变化的反应,前三项中均有单质参加或生成,化合价均有变化,是氧化还原反应,D项没有元素化合价发生变化,是非氧化还原反应。
点评:当元素处于最高价态时只有氧化性,最低价态时只有还原性,中间价态时既有氧化性又有还原性。属于简单题。
本题难度:简单
4、选择题 金属铈(稀土元素)性质活泼。铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。下列说法正确的是
A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑
B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + Fe2+=Ce3+ + Fe3+
C.在一定条件下,电解熔融状态的CeO2制Ce,在阳极获得铈
D.四种铈的核素 Ce、
Ce、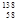 Ce、
Ce、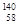 Ce、
Ce、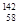 Ce,它们互称为同素异形体
Ce,它们互称为同素异形体
参考答案:C
本题解析:A、氧化性是Ce4+>I2,因此Ce4+和I-不能共存,所以选项A不正确;B、根据氧化性是Ce4+>Fe3+>I2可知,应该发生的反应为Ce4++Fe2+=Ce3++Fe3+,故B不正确;C、电解池中阴极得到电子,阳极失去电子,所以电解熔融状态的CeO2时,在阴极上是Ce4+得电子生成单质铈的过程,即在阴极获得铈,故C正确;D、同素异形体是同种元素组成的不同单质间的互称,四种铈的核素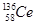 、
、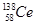 、
、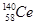 、
、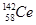 它们互称为同位素,故D错误,答案选C。
它们互称为同位素,故D错误,答案选C。
本题难度:一般
5、选择题 黑火药的爆炸反应方程式可表示为:
2KNO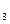 +S+3CK
+S+3CK S+N
S+N ↑+3CO
↑+3CO ↑
↑
其中氧化剂是(?)
A.C
B.KNO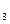
C.KNO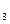 和S
和S
D.S
参考答案:C
本题解析:有两种元素的价态降低,KNO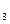 中的N(+5价→0价)和另一种元素S(0价→-2价)。
中的N(+5价→0价)和另一种元素S(0价→-2价)。
本题难度:一般