微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
[? ]
A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性
D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
[? ]
A.盐溶液都是中性的
B.盐溶液的酸碱性与盐的类型无关
C.碳酸钠溶液显碱性,是因为溶液中c(OH-)>c(H+)
D.NaHCO3溶液显酸性
参考答案:C
本题解析:
本题难度:一般
3、选择题 已知298K时,Mg(OH)2的溶度积常数Ksp=4.0×10-12,向c(Mg2+)=1mol·L-1的MgCl2溶液中滴加NaOH调节
pH,则开始出现白色沉淀时溶液的pH(精确到整数)约为(lg2=0.301)
[? ]
A.8
B.9
C.10
D.11
参考答案:B
本题解析:
本题难度:一般
4、填空题 测试和调控溶液的PH ,对工农业生产、科学研究等有重要的意义,完成下列关于PH 的计算和比较。
(1)?常温下,下列溶液中PH由大到小的顺序是_____________?。水电离出的c(OH-)由大到小的顺序是:________________________?
?① 0.1 mol/L NaOH 溶液?② 0.1 mol/L Ba(OH)2溶液? ③?0.1 mol/L CH3COOH 溶液?④ 0.1 mol/L HCl溶液?⑤ 0.1 mol/L NH4Cl溶液?
(2)?水的电离平衡曲线如图所示
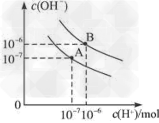
①若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到95℃时,水的电离平衡状态移动到B点,则此时水的离子积从________变化到_________。
②?将pH=8 的Ba(OH)2溶液与pH=5 的稀盐酸混合,并保95 ℃的恒温,若混合溶液呈中性,则Ba(OH)2和盐酸的体积比为__________________ 。
(3)一定温度下,有a 、盐酸;b 、硫酸;c 、醋酸三种酸的稀溶液。( 用a 、b 、c 、<、=、>号填写)
①同体积同物质的量浓度的三种酸,中和NaOH 能力的顺序是_____ ,
②当其c(H+) 相同时,物质的量浓度由大到小的顺序为___________ ,
③当c(H+) 相同、体积相同时,分别加入足量相等表面积的锌,反应开始时的速率大小为:? ?,相同状况产生的气体体积由大到小的顺序为__________________ 。
④将c(H+) 相同的三种酸均稀释10 倍,c(H+) 由大到小的顺序为______ 。
参考答案:(1)②①⑤③④;? ⑤>③ >①=④>② (2)① 10-14? 10-12?② 1:10?(3)①b >a =c ; ②c >a >b ;?③a =b=c ;c >a =b? ④c >a =b ;
本题解析:
本题难度:一般
5、填空题 已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示
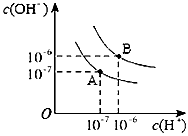
(1)则25 ℃时,水的电离平衡曲线应为__________(填“A”或“B”),请说明理由___________________________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与
H2SO4溶液的体积比为__________。
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_____________________。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:______________。
参考答案:(1)A;水的电离是吸热过程,温度低时,电离程度小,c(H+)·c(OH-)小
(2)10∶1
(3)a+b=14(或pH1+pH2=14)
(4)曲线B对应95 ℃,此时水的离子积为10-12,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5
本题解析:
本题难度:一般