微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
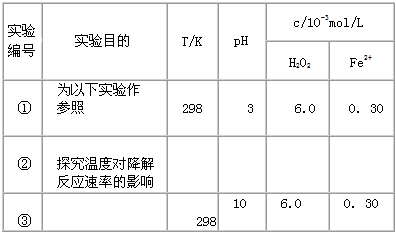
[实验设计] 控制p - CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
[数据处理] 实验测得p - CP的浓度随时间变化的关系如下图。
|

(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:
v(p - CP)=_________mol·L-l·s-l
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从
Fenton法所用试剂H2O2的角度分析原因:____________________________
(4)实验③得出的结论是:pH等于10时,____________________________。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:_______________________________。
参考答案:(1)②313;3;6.0;0. 30;③探究溶液的pH对降解反应速率的影响
(2)8.0×10-6
(3)过氧化氢在温度过高时迅速分解
(4)反应速率趋向于零(或该降解反应趋于停止)
(5)将所取样品迅速加入到一定量的NaOH溶液中,使pH约为10(或将所取样品骤冷,答案合理即可)
本题解析:
本题难度:困难
2、实验题 某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应。
可能发生的反应有:
2Fe3++SO32-+H2O==2Fe2++SO42-+2H+(氧化还原反应)
2Fe3++3SO32-+6H2O==2Fe(OH)3(胶体)+3H2SO3(水解反应)
为了证明反应的实际情况,同学们设计并实施了下列实验,请填写下列空白:
实验I:
学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,实验者设计这个实验的目的是____。
实验Ⅱ:
①取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 ____。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是___。将溶液分成两等份,其中一份加入KSCN稀溶液,溶液变成血红色,反应的离子方程式为____。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是____。
②换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ。与实验Ⅱ产生的现象完全相同。由上述实验得出的结论是____。
实验Ⅲ:
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是____。从形式上看,Na2CO3和Na2SO3相似。但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:① ____;②____。
参考答案:实验I:
检验Na2SO3是否变质(或检验Na2SO3溶液中是否混有Na2SO4)
实验Ⅱ:
①氢氧化铁胶体(或胶体); 先产生红褐色 淀,后沉淀逐渐溶解,溶液变为黄色,有气泡产生;
Fe3++ 3SCN-==Fe(SCN)3? ;Ba2++SO42-==BaSO4↓
②Fe3+与SO32-同时发生氧化还原反应和双水解反应
实验Ⅲ:
2Fe3++ 3CO32-+3H2O==2Fe(OH)3↓+3CO2↑ ;
①SO32-有较强的还原性,CO32-没有还原性;②SO32-水解能力较CO32-小
本题解析:
本题难度:一般
3、实验题 菠菜营养丰富,素有“蔬菜之王”的美称。民间流传:菠菜豆腐同食,易得结石。某化学兴趣小组对“菠菜豆腐是否能同食”等阃题进行了探究。
【查阅资料】①菠菜含有丰富的铁、草酸盐、碳酸盐等,豆腐中含有丰富的蛋白质及钙盐。②人体结石的主要成分:草酸钙(CaC2O4) ③醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐。
【提出猜想】“菠菜豆腐不能同食”的原因可能是_____________________。
【探究一】菠菜中部分成分分析
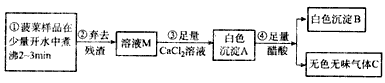
(1)步骤③中加入足量的CaCl2溶液的目的是________________________。
(2)已知气体C能使澄清石灰水变浑浊,醋酸的化学式用HAc表示,写出步骤④的化学反应方程式____________________,步骤②所需要的玻璃仪器是_______________________。
(3)白色沉淀B的化学式为________________________,由此可见菠菜豆腐不能同食。以下饮食观点正确的是__________(填字母)。
A.禁吃菠菜 B.高钙牛奶可与菠菜同食 C.菠菜烹饪前可用开水烫,可降低草酸盐含量
【探究二】某草酸钙晶体(CaC2O4·xH2O)热分解研究按下图示装置将草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)。
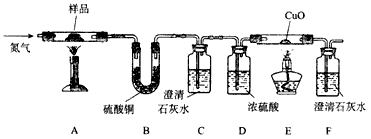
(4)①反应开始前通入氮气的目的是_______________。②装置B中硫酸铜粉末变蓝,说明产物中有________________,C、F 中澄清石灰水均变浑浊,E中CuO变红,说明产物还有_______________和____________,经检验A中残留固体为氧化物。③对上述装置从环保角度提一个改进建议___________________。
(5)某研究所利用SDTQ600热分析仪对草酸钙晶体(CaC2O4·xH2O)进行热分解,获得相关数据,绘制成固体质量-分解温度的关系如下图。
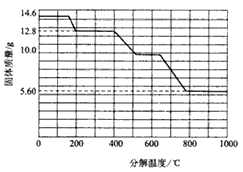
①800℃以上时,固体成分的化学式为____________;
②计算CaC2O4·xH2O中的x=_________________;
③残留固体为CaC2O4时的温度范围为________________;写出固体质量由12.8g变为10.0g时的化学方程式______________________。
参考答案:菠菜中草酸盐与豆腐中钙盐反应生成草酸钙
(1)使溶液M中的草酸盐、碳酸盐完全沉淀
(2)CaCO3+2HAc=Ca(Ac)2+H2O+CO2↑;漏斗、烧杯、玻璃棒
(3) CaC2O4;C
(4)①排尽装置内的空气(防止CO还原CuO时发生爆炸);②H2O、CO2、CO;③在装置F后增加尾气处理装置
(5)①CaO;②1;③200-400℃;CaC2O4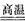 CaCO3+CO↑
CaCO3+CO↑
本题解析:
本题难度:一般
4、选择题 下列关于物质的检验说法不正确的是( )
A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子
B.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后在用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察
C.待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定有NH4+?存在
D.某溶液中滴入KSCN溶液后呈红色,说明该溶液中有Fe3+
参考答案:A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,可能含硫酸根离子或银离子,但二者不能同时存在,故A错误;
B.将铂丝放在稀盐酸中洗涤后灼烧至无色,然后在用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,为避免钠的黄光的影响,则透过蓝色钴玻璃进行观察K的焰色,故B正确;
C.因铵盐与碱反应生成氨气,氨气使湿润的红色石蕊试纸变蓝,则待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定有NH4+存在,故C正确;
D.铁离子遇KSCN溶液变血红色,则溶液中滴入KSCN溶液后呈红色,说明该溶液中有Fe3+,故D正确;
故选A.
本题解析:
本题难度:简单
5、实验题 为探究外界条件对H2(g)+I2(g)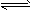 2HI (g) △H<0 反应速率的影响,设计下表所示实验
2HI (g) △H<0 反应速率的影响,设计下表所示实验

|
(1)完成上表中的空格。
(2)实验Ⅰ中,I2的物质的量浓度(c)随时间(t)的变化如下图所示。
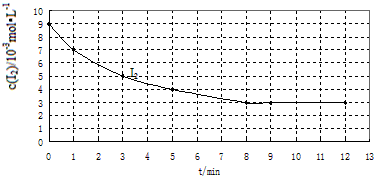
根据图中数据回答下列问题:
①在0~1min内反应的平均速率ν(HI)= _________。
②在给出的坐标图中画出实验Ⅱ、Ⅲ中I2的物质的量浓度(c)随时间(t)变化的曲线,并进行必要的标注。
③保持容器容积不变,向其中加入1molH2,反应速率____________(选填“加快、减慢、不变、不确定”)。
④该同学还想用此反应研究压强对化学平衡移动的影响,请问能否达到实验目的? _________(填“能”、不能”),原因是__________________________
参考答案:(1)III温度:457
(2)①4×10-3mol·L-1·min-1②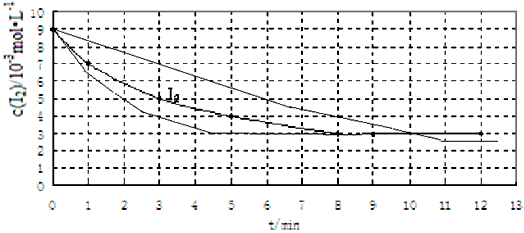 ③加快;④不能,该反应前后气体计量数相等,平衡不受压强的影响
③加快;④不能,该反应前后气体计量数相等,平衡不受压强的影响
本题解析:
本题难度:困难