微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6 分)某研究学习小组在做过氧化钠与水反应实验时,发现过氧化钠与水反应后的溶液滴加酚酞呈红色,但不久红色褪去。甲、乙、丙三个同学对此现象分别做了如下推测:
甲:因为反应后试管很热,所以很可能是溶液温度较高使红色褪去。
乙:查阅资料上载“酚酞在浓的碱溶液中因生成三钠盐而呈无色。”实验所加的水较少,红色褪去可能是生成的氢氧化钠溶液浓度较大的影响。
丙:过氧化钠具有强氧化性,生成物中O2 、H2O2(可能产物)等也具有强氧化性,可能是氧化漂白了红色物质。
(1)验证甲是否正确的方法是_________________________
(2)验证乙是否正确的方法是_________________________
参考答案:(1)冷却后加酚酞试液或冷却后看溶液是否变红;
(2)加水稀释后看溶液是否变红
本题解析:略
本题难度:简单
2、填空题 (每空1分,共12分)
(1)浓硫酸与木炭粉在加热条件下的化学方程式为____________。
(2)已知酸性KMnO4溶液可以吸收SO2,试用图4-6所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号): __________→__________→__________→__________。
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是________,B瓶溶液的作用是_________,C瓶溶液的作用是_________________________。
(4)装置②中所加的固体药品是_______________,可确证的产物是_______。
(5)装置③中所盛溶液是__________,可验证的产物是__________。
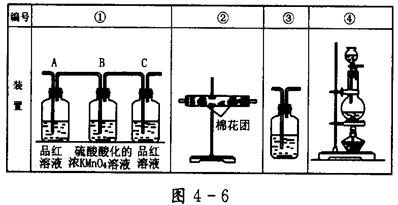
参考答案:(1)2H2SO4+C2SO2↑+ CO2↑+2H2O ?(2)④②①③?(3)检验SO2?
除去SO2?检验SO2是否除尽? (4)无水CuSO4? H2O ?(5)Ca(OH)2溶液? CO2
本题解析:(1)浓硫酸具有强氧化性,和碳的反应的方程式为2H2SO4+C2SO2↑+ CO2↑+2H2O。
(2)生成物有三种:CO2、SO2、水蒸气。由于检验CO2和SO2均需要通过溶液,所以要首先检验水蒸气,一般用无水硫酸铜来检验。检验SO2一般用品红溶液,检验CO2一般用澄清石灰水,但SO2也能是澄清石灰水变混浊,所以要在检验CO2之前先检验SO2,且在通入澄清石灰水之前还要除去SO2,吸收SO2可以用酸性高锰酸钾溶液。为了验证是否除尽,还需要再一次通过品红溶液。
本题难度:一般
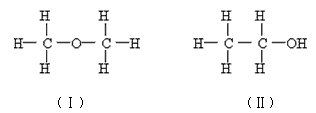
3、实验题 某探究学习小组用下面这套装置测定乙醇结构:已知乙醇的分子组成为C2H6O,为探究其结构式究竟是以下(Ⅰ)式还是(Ⅱ)式中的哪一种,该小组同学利用乙醇与金属钠的反应进行如下探究:
? 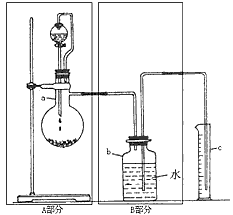
① 所测得的一组实验数据如下:
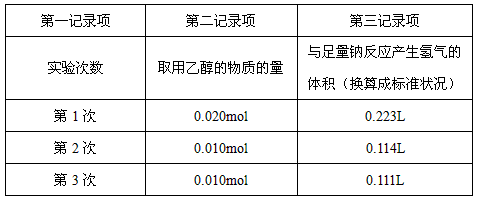
他们根据以上数据推断乙醇的合理结构不应是___________式(填写“I”或“II”),理由为:____________________。
② 从实验的实际过程中,该组同学体会到,他们的数据记录方式存在科学性问题,即记录的不是原始数据而是换算数据。你认为表中的第二记录项应改为_______________,第三记录项应改为__________,为使实验记录更加科学、准确,还应增加的一个实验记录项是_______________________。
参考答案:① Ⅰ; 根据实验数据,0.10 mol乙醇与足量钠反应能置换出0.05mol氢气,即被置换的H为0.10mol,说明分子中的6个氢原子所处的化学环境并不完全相同,(有1个应不同于其他),从而确定乙醇的结构为Ⅱ式。
② 取用乙醇的质量(或体积); 排出水的体积;实验温度或实验温度与体系内压强
本题解析:
本题难度:一般
4、实验题 设计一个实验,能通过观察到明显的现象,说明CO2与NaOH溶液发生了反应。实验用品:集气瓶、烧瓶、分液漏斗、长颈漏斗、导管、橡皮管、弹簧夹、烧杯、量筒、水、CO2气体、NaOH溶液以及你认为所能用到的仪器和药品。现有五位学生装设计了如图所示五个装置,试回答:
(A)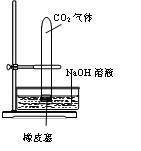 ?(B)
?(B)
(C)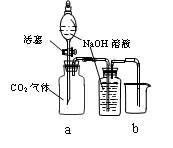 (D)
(D)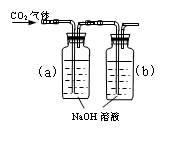
(E)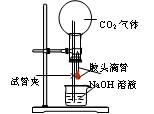
⑴对图A-E,请指出能达到实验目的的装置_______(用A、B、C、D、E填空),并说明能证明CO2与NaOH溶液发生了反应的操作及实验现象,将结果填入下表:
装置
| 实验方法
| 实验现象
|
?
| ?
| ?
|
?
| ?
| ?
|
?
| ?
| ?
|
?
| ?
| ?
|
?
| ?
| ?
|
⑵能否设计出其它一些方法来证明CO2与NaOH溶液发生了反应。
参考答案:⑴
装置
实验方法
实验现象
A
将分液漏斗中的NaOH溶液滴入烧瓶
看到水槽中的水被吸入到烧瓶中
B
将充满CO2的试管的橡皮塞打开
水槽中的NaOH溶液上升到试管中
C
通过分液漏斗向充满CO2气体的集气瓶a中加入NaOH溶液
b中NaOH溶液不能排入烧杯中
D
向a瓶中通入CO2气体
B中无气泡冒出
E
将滴管中的NaOH溶液挤入烧瓶
产生喷泉现象
本题解析:⑴从CO2与NaOH溶液发生了反应后,CO2的减少导致压强的减小或气泡的减少角度思考,都能达到实验的要求。反应的操作及实验现象如下:
装置
实验方法
实验现象
A
将分液漏斗中的NaOH溶液滴入烧瓶
看到水槽中的水被吸入到烧瓶中
B
将充满CO2的试管的橡皮塞打开
水槽中的NaOH溶液上升到试管中
C
通过分液漏斗向充满CO2气体的集气瓶a中加入NaOH溶液
b中NaOH溶液不能排入烧杯中
D
向a瓶中通入CO2气体
B中无气泡冒出
E
将滴管中的NaOH溶液挤入烧瓶
产生喷泉现象
⑵可以从CO2和NaOH溶液发生反应生成的产物角度分析考虑,得到如下方法(其它合理的想法也可以):A:将反应后所得的溶液适当加热后无大量气泡冒出,测定NaOH溶液反应前后的pH减小,说明是酸性氧化物CO2作用于强碱性物质NaOH。B:在反应后的产物中加入盐酸,产生无色无味、能是澄清石灰水变浑浊的气体,为CO2。C:在BaCl2溶液中分别加入NaOH溶液和通入CO2无明显现象,但若既加入NaOH溶液,又通入CO2,则有白色沉淀生成,意味NaOH溶液和CO2发生了反应D:对照实验:在等量的已通入较多的CO2的NaOH溶液和未通入CO2的NaOH溶液中加入铝片,观察生成气泡的速率。
本题难度:一般
5、实验题 某研究性学习小组对过量炭粉与氧化铁(Fe2O3)反应的气体产物成分进行研究。
(1)提出假设 ①气体产物是CO2。?②气体产物是CO。?③气体产物是__________。
(2)设计方案? 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
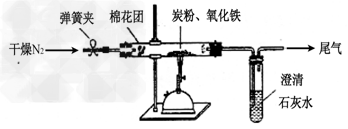
(3)查阅资料氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,该反应的离子方程式:_______________。
(4)实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g; ?
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为_____________。
(5)数据处理试根据实验数据分析判断,前面的假设_________(填①、②、③)是正确的。写出该实验中氧化铁与碳发生反应的化学方程式:______________________。
参考答案:(1)CO2、CO的混合物?
(3)NH4++NO2- N2↑+2H2O
N2↑+2H2O
(4)步骤②中是为了排尽空气、步骤④是为了赶出所有的CO2,确保完全吸收 ?
(5)③;2C+Fe2O3 2Fe+CO↑+CO2↑
2Fe+CO↑+CO2↑
本题解析:
本题难度:一般