微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是

[? ]
A.Zn是阴极
B.负极上发生还原反应
C.正极发生的反应是 Cu2+ + 2e- === Cu
D.负极发生的反应是 Zn - 2e- === Zn2+?
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列关于如图所示装置的叙述,正确的是( )
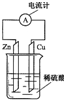
A.铜片是负极,锌片上有气泡产生
B.锌片和铜片都不断溶解,溶液逐渐变为蓝色
C.该装置可以将电能转化为化学能
D.电子从锌片流出,经导线流向铜片
参考答案:A、活泼金属锌作负极,铜作正极,负极上锌失电子,正极铜上氢离子得电子生成氢气,故A错误;
B、锌作负极,锌失电子生成锌离子进入溶液,导致锌片的质量减轻;铜片上氢离子得电子生成氢气,铜片质量不变,故B错误;
C、原电池是将化学能转换为电能的装置,故C错误;
D、电子从负极沿导线流向正极,即电子从锌片流出,经导线流向铜片,故D正确.
故选D.
本题解析:
本题难度:一般
3、选择题 将锌片和铜片用导线连接后放入稀硫酸溶液中发生原电池反应,下列叙述正确的是( )
A.负极附近的SO42-浓度逐渐增大
B.正极有O2逸出
C.电子通过导线由铜片流向锌片
D.铜片上有H2逸出
参考答案:A、原电池放电时,溶液中阴离子向负极移动,所以阴极附近的SO42-浓度逐渐增大,故A正确;
B、正极上氢离子得电子生成氢气,故B错误;
C、原电池放电时,电子从负极沿导线流向正极,即电子通过导线由锌片流向铜片,故C错误;
D、铜片作正极,正极上氢离子得电子生成氢气,故D正确;
故选AD.
本题解析:
本题难度:简单
4、选择题 将Al片和Cu片用导线连接后,插入盛浓硝酸的烧杯中,下列叙述正确的是
[? ]
A.Al为负极,电极反应为:Al-3e-=Al3+
B.Cu为负极,Al极上析出H2
C.Cu为正极,发生氧化反应
D.Al为正极,电极反应为:4H++2NO3-+ 2e-=2NO2↑+2H2O
参考答案:D
本题解析:
本题难度:一般
5、填空题 (10分)金属铬和氢气在工业上都有重要的用途。已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4)。
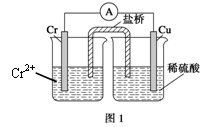

(1)铜铬构成原电池如右图1,其中盛稀硫酸烧杯中的现象为: 。盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是:
A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液
B.理论上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池
C.此过程中H+得电子,发生氧化反应
D.电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中