微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 教材必修一课后习题中关于过氧化钠的性质探究实验,某同学在学习后做了如下改进并进行实验:经过改进,用脱脂棉包住约0.2 g 过氧化钠粉末,置于石棉网上,往脱脂棉上滴加几滴水,可观察到脱脂棉剧烈燃烧起来。
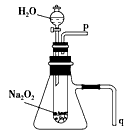
(1)由实验现象所得出的有关Na2O2和H2O反应的结论是: a有氧气生成;b_____________。
(2)某学校研究性学习小组拟用如图所示装置进行实验,以证明上述结论。
①用以验证结论a的实验操作方法及现象是_____________。
②用以验证结论b的实验操作方法及现象是_____________。
(3)该研究性学习小组的同学认为Na2O2和H2O反应可生成H2O2,现请你设计一个简单的实验证明Na2O2和足量的H2O充分反应后的溶液中有H2O2存在。(只要求列出实验所用的试剂及观察到的现象)
试剂:__________________________。现象:__________________________。
参考答案:(1)反应放出热量
(2)①加水后,将带火星的木条置于导管口P处,发现木条复燃;②将导管q插入水槽中,再打开分液漏斗的开关,发现q处有气泡放出
(3)MnO2;放出使带火星的木条复燃的气体(其他合理答案也可以)
本题解析:
本题难度:一般
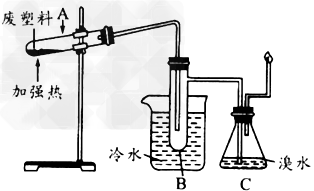
2、实验题 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图所示。
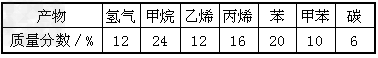
加热聚丙烯废旧塑料得到的产物如下表
(1)试管A中残余物质有多种用途,下列所示的转化就可制取高聚物聚乙炔。

写出反应②③的化学方程式:_________________、__________________。?
(2)试管B中收集到的物质有两种,其中的一种能使酸性高锰酸钾溶液褪色,这种物质的一氯代物有_______种。 ?
(3)锥形瓶C中观察到的现象是________________________。?
(4)写出C中逸出的气体在工业上的两种用途:______________。
参考答案:(1)CaC2+2H2O→CH≡CH↑+Ca(OH)2、 nCH≡CH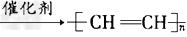 ?
?
(2)4?
(3)液体由橙色变为无色?
(4)用作燃料、用作化工原料
本题解析:
本题难度:一般
3、实验题 (16分) I、实验室中常以BaSO4重量法测定BaCl2·nH2O中的Ba的含量主要步骤如下:
①?灼烧瓷坩埚至恒重,称得坩埚的质量
② 称取BaCl2·nH2O并在烧杯中溶解,加盐酸处理
③ 将一定浓度的过量硫酸滴入钡盐中得到白色沉淀
④ 静置,?
⑤ 将沉淀和滤纸置于瓷坩埚中,经酒精喷灯加热碳化后,继续在800-850℃灼烧至恒重,称重
⑥ 计算
请回答下列问题:
(1)省略第①步中“灼烧瓷坩埚至恒重”可能导致计算结果_ ______(填“偏高”、“不变”或“偏低”)。
______(填“偏高”、“不变”或“偏低”)。
(2)第④步静置后的操作是?。
(3)第⑤步灼烧温度不超过900℃,是因为_______________________。
II、某同学用氨水吸收一定量的SO2,吸收后溶液中可能含有OH-、SO32-、SO42-、 HSO3- 等阴离子中的若干种。
(4)写出氨水吸收过量SO2的反应的离子方程式:?
(5)已知亚硫酸氢盐一般可溶于水。仅限选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。请设计实验探究吸收后溶液中是否存在SO32-、HSO3-,将实验操作、预期的实验现象和结论填在下表中。
实验操作
| 预期现象与结论
|
步骤1:取少量待测液放入试管1中,滴加过量lmol/L氯化钡溶液。
| 若不出现浑浊,则溶液中不存在SO32-,
若出现浑浊,则溶液中可能含有SO32-。
|
步骤2:若出现浑浊,静置一段时间后,将上层清液倒入试管2中。往试管1中加入蒸馏水洗涤沉淀,静置后弃去上层清液,再加入?。
| ?
|
步骤3:
| ?
|
?
参考答案:(16分)
(1)偏低?(2分)?(2)过滤、洗涤沉淀(2分)
(3)硫酸钡会被碳还原(或“部分硫酸钡会发生分解”)(2分)
(4)NH3·H2O + SO2 = NH4+ + HSO3-?(2分)
(5)
实验操作
预期现象与结论
步骤2: 2mol/L盐酸。(1分)
若加盐酸后出现气体,则证明溶液中存在SO32-。
若无气体,则不存在SO32-。(2分)
步骤3:在试管2中加入过量2mol/L盐酸,再滴入2滴品红。
或:在试管2中加入过量lmol/L氢氧化钡溶液。(3分)
红色褪去,则存在HSO3-,红色不褪去,则不存在HSO3-。
或:出现浑浊,则存在HSO3-,不出现浑浊,则不存在HSO3-。(2分)
本题解析:略
本题难度:一般
4、实验题 (15分)从固体混合物A出发可以发生如下框图所示的一系列变化。

(1)在实验室,气体C的检验方法是??。 ? (2)操作②的名称是 ?,该操作所使用的玻璃仪器有?。
(3)写出下列反应的离子方程式:
反应③ ??;
反应④ ??。
(4)实验中多余的气体I必须吸收,以免污染空气。下图是实验室用NaOH吸收气体I的装置,为防止产生倒吸现象,不合理的装置是??(填序号)。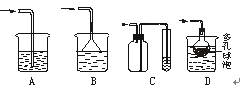
参考答案:

本题解析:略
本题难度:简单
5、实验题 医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量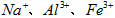 等杂质)生产医药级二水合氯化钙(
等杂质)生产医药级二水合氯化钙(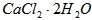 的质量分数为97.0%~103.0%)的主要流程如下
的质量分数为97.0%~103.0%)的主要流程如下

(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量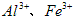 。检验
。检验 是否沉淀完全的试验操作是___________________。
是否沉淀完全的试验操作是___________________。
(2)酸化操作是加入盐酸,调节溶液的约pH为4.0,其目的有:
①将溶液中少量的 转化为
转化为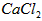 ;
;
②防止 在蒸发时水解;
在蒸发时水解;
③___________________。
(3)测定样品中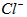 含量的方法是:
含量的方法是:
a.称取0.7500g样品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用0.05000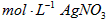 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积的平均值为20.39mL。
溶液体积的平均值为20.39mL。
①上述测定过程中需要溶液润洗的仪器有___________________。
②计算上述样品中 的质量分数为___________________。
的质量分数为___________________。
③若用上述办法测定的样品中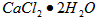 的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________________;___________________。
的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________________;___________________。
参考答案:(1)取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe(OH)3沉淀完全
(2)防止溶液吸收空气中CO2
(3)①酸式滴定管;②99.9%;③样品中存在少量的NaCl;少量的CaCl2·2H2O失水
本题解析:
本题难度:一般