微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验中金属或氧化物可以完全溶解的是
A.1 mol铜片与含2 mol H2SO4的浓硫酸共热
B.1 mol MnO2粉末与含2 mol H2O2的溶液共热
C.常温下1 mol铝片投入足量的浓硫酸中
D.常温下1 mol铜片投入含4 mol HNO3的浓硝酸中
参考答案:D ?
本题解析:A项Cu与浓H2SO4反应,但随反应的进行,溶液变稀,Cu有剩余,B项MnO2为H2O2分解的催化剂,C项Al在常温下,在浓硫酸中钝化;D项Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,尽管n(Cu)∶n(HNO3)=1∶4,但随反应的进行,浓HNO3变稀,则发生反应3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,此时n(Cu)∶n(HNO3)=3∶8>1∶4,即HNO3仍有剩余,Cu完全溶解。
本题难度:一般
2、选择题 把足量的铁粉投入到溶解有硫酸和硫酸铜的溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO42-的物质的量浓度之比为
A.1:4
B.2:7
C.1:2
D.3:8
参考答案:A
本题解析:掌握“差量法”的运用
铁粉发生的反应为(设硫酸铜、硫酸分别为xmol、ymol):
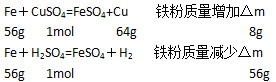
依题意可知:8x=56y,即x:y=7:1
则可计算出原溶液中H+与SO42-的物质的量浓度之比为:2×1:(7+1)=1:4
答案为A
本题难度:一般
3、选择题 下列物质中,含碳量最高的是
A.高碳钢
B.白口铁
C.中碳钢
D.合金钢
参考答案:D
本题解析:合金钢中碳的含量在2%~4%之间,而碳素钢中碳的百分含量在0.3%~2%之间。
本题难度:简单
4、选择题 有一种物质俗称铁红,常用作红色油漆和涂料,它的化学式为(? )
A.FeO
B.Fe2O3
C.Fe
D.Fe3O4
参考答案:B
本题解析:
铁在吸氧腐蚀时产生铁锈,此为原电池原理,负极2Fe-4e-=2Fe2+,正极4e-+O2+2H2O=4OH-,总反应式2Fe+O2+2H2O=2Fe(OH)2,氢氧化亚铁被空气中的氧气氧化为氢氧化铁,氢氧化铁再分解生成氧化铁Fe2O3,这是红色物质,俗称铁红。
本题难度:简单
5、填空题 把2.0 mol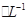 CuSO4和1.0 mol
CuSO4和1.0 mol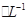 H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:?
H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:?
(1)混合溶液中CuSO4和H2SO4的物质的量浓度
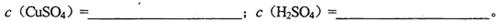
(2)混合液中和的物质的量浓度

(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余。此时溶液中的物质的量浓度。c(Fe2+)=_______________________。
参考答案:(1)1.0mol/L;0.5mol/L;
(2)1mol/L;1.5mol/L;(3)1.5mol/L
本题解析:(1)把2.0mol?L-1CuSO4和1.0mol?L-1H2SO4溶液等体积混合,根据稀释定律,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO4)="1/2×1.0mol/L=1.0" mol/L,c(H2SO4)=1/2×1.0mol/L=0.5mol/L,
(2)混合后溶液中c(H+)=2c(H2SO4)=2×0.5mol/L=1mol/L,
溶液中硫酸根来源于硫酸铜与硫酸电离,故 c(SO42-)═c(CuSO4)+c(H2SO4)=1mol/L+0.5mol/L=1.5mol/L,
(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-)=1.5mol/L,
本题难度:一般