微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (6分)
在某温度下,将H2和I2各1.0 mol充入容积为10L的密闭容器中,充分反应达到衡后,测得C(H2)=0.080mol/L。
(1)求该反应的平衡常数。
(2)、在上述温度下,该容器中若通入H2和I2蒸气各2.0 mol,求达到平衡时各物质的浓度。
参考答案:(6分)
(1)K==0.25
(2) c(H2)==c(I2)="=0.16" mol/L? c(HI)="=0.08" mol/L
本题解析:略
本题难度:一般
2、选择题 下列事实不能用勒夏特列原理解释的是
A.工业制取金属钾:Na(l)+ KCl(l) NaCl(l)+ K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+ K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
B.冰镇啤酒瓶,把啤酒倒入玻璃杯,杯中立即泛起大量泡沫。
C.在实验室可用排饱和食盐水的方法收集氯气。
D.对于2HI(g) H2(g)+I2(g);ΔH>0,缩小容器的体积可使颜色变深。
H2(g)+I2(g);ΔH>0,缩小容器的体积可使颜色变深。
参考答案:D
本题解析:能用勒夏特列原理解释的反应必须存在平衡,而且平衡必须移动。A项有化学平衡,而且K以蒸汽的形式从体系中分离出来,平衡移动。B项有溶解平衡,而且压强改变,溶解度减小,平衡移动。C项有溶解平衡,而且同离子效应,平衡移动。D项有化学平衡,但是压强该变平衡没有移动。答案选D。
点评:列夏特列原理是用来解释平衡移动的原理。
本题难度:一般
3、填空题 (15分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g) 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
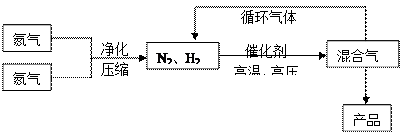
气体
| 氮气
| 氢气
| 氨
|
熔点(℃)
| -210.01
| -252.77
| -77.74
|
沸点(℃)
| -1 95.79 95.79
| -259.23
| -33.42
|
?
反应体系中各组分的部分性质见上表:
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到?℃使混合气体分离出来产品;继续循环的气体是?。
(2)工业上采取用上述 (1)操作的目的:?
(1)操作的目的:?
?。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________?。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应: N2(g)+3H2(g) 2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
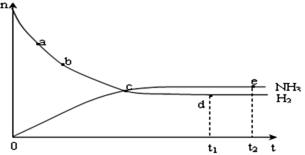
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻, n(H2)比上图中d点的值大?
参考答案:

本题解析:略
本题难度:一般
4、选择题 某温度下,在体积为5L的密闭容器中,充入1mol?A气体,发生如下可逆反应:2A(g)?B(g)+C(g);△H=+akJ?mol-1?(a>0),2min后反应达到平衡,A为0.4mol下列叙述中不正确的是( )
A.0~2?min时间内B物质的平均反应速率为0.03?mol/(L?min)
B.充分反应后,反应吸收的热量小于0.5a?kJ
C.达平衡后,保持温度和容器体积不变,再充入1?mol?A,平衡向正反应方向移动
D.若温度和容器体积不变,起始时充入B和C各0.5?mol,则达平衡时,n(A)等于0.4?mol
参考答案:A、平衡时A的物质的量为0.4mol,参加反应的A的物质的量为1mol-0.4mol=0.6mol,结合方程式可知生成B的物质的量为0.6mol×12=0.3mol,故v(B)=0.3mol5L2min=0.03mol/(L?min),故A正确;
B、平衡时A的物质的量为0.4mol,参加反应的A的物质的量为1mol-0.4mol=0.6mol,根据2A(g)?B(g)+C(g);△H=+akJ?mol-1?(a>0)可知,吸收的热量为akJ×0.6mol2mol=0.3akJ,故B错误;
C、达平衡后,保持温度和容器体积不变,再充入1mol?A,反应向正反应方向移动,等效为增大压强,该反应前后气体的物质的量不变,为等效平衡,平衡状态相同,故C正确;
D、温度和容器体积不变,起始时充入B和C各0.5?mol,按化学计量数转化到左边可得1molA,与原平衡为等效平衡,平衡时对应组分的物质的量相同,平衡时A的物质的量为0.4mol,故D正确;
故选B.
本题解析:
本题难度:简单
5、简答题 已知反应:3I-(aq)+
(aq)?I(aq)+(aq)
(1)写出反应的平衡常数表达式K=______;
(2)如图表示反应过程中有关物质的能量,则反应的△H______0(填“>”、“<”或“=”);
(Ⅰ)、(Ⅱ)两线中,使用催化剂的是______线;
(3)反应中发生反应的I-与被氧化的I-的物质的量比为______;
(4)反应的速率可以用与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,记录的数据如下:
| 实验编号 | ① | ② | ③ | ④ | ⑤
c(I-)/mol?L-1
0.040
0.080
0.080
0.160
0.160
c()/mol?L-1
0.040
0.040
0.080
0.080
0.040
t/s
88
44
22
11
t1
|
则:该实验的目的是______,显色时间t1=______s,分析表中数据,得出的结论是______.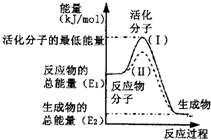
参考答案:(1)反应3I-(aq)+S?2O2-8(aq)?I?-3(aq)+2SO2-4(aq)的平衡常数k=c(I-3)?c2(SO2-4)c3(I-)?c(S2O2-8),故答案为:c(I-3)?c2(SO2-4)c3(I-)?c(S2O2-8);
(2)由图可知,反应物的总能量高于生成物的总能量,该反应为放热反应,所以△H<0;
催化剂降低活化能,改变反应途径,提高反应速率,但不影响反应热,故(Ⅱ)表示使用催化剂,
故答案为:<;(Ⅱ);
(3)根据方程式可知,I3-可看做I2和I-相结合形成的微粒,故发生反应的I-与被氧化的I-的物质的量比为3:2,故答案为:3:2;
(4)由题目中表格数据可分析出c(I-)、c(S2O32-)浓度越大,反应速率越快,显蓝色所需时间越少,故实验目的应是研究反应物I-与S2O82-的浓度对反应速率的影响.
对比数据组①和②、③和④,可以看到,c (S2O82-)不变,c (I-)增大到2倍时,反应时间缩短了一半,即反应速率加快了一倍;
对比数据组②和③,可以看到,c (I-)不变,c (S2O82-)增大到2倍时,反应时间缩短了一半,即反应速率也加快了一倍;
对比数据组对比数据组①和③,可以看到,c (I-)和c (S2O82-)均增大到2倍时,反应时间为原反应时间的1/4,即反应速率加快了4倍.
可见两个反应物的浓度和反应速率之间的数学关系是:反应物浓度每增加一倍,反应时间就减少一倍,对于两个反应物来说都是如此,
可得出结论:反应速率与反应物起始浓度乘积成正比.
对比实验①和⑤,实验⑤的c (I-)为实验①的4倍,而c (S2O82-)保持不变,则由此可计算实验⑤的反应时间应为实验①反应时间的1/4,即t1=88s×14=22s.
故答案为:研究反应物I-与S2O82-的浓度对反应速率的影响;22s;反应速率与反应物起始浓度乘积成正比.
本题解析:
本题难度:一般