微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)配平氧化还原反应方程式:
___C2O42-+___MnO4-+___H+=___CO2+___Mn2++___H2O
(2)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为_________mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由____________变为____________。该溶液中还原剂的物质的量为_________mol。
③原试样中H2C2O4·2H2O的质量分数为____________。
参考答案:(1)5 2 16 10 2 8
(2)①0.005;②无色;紫红色;0.004;③21%
本题解析:
本题难度:一般
2、选择题 【3分】在水溶液中离子可以将Fe3+还原成Fe2+,本身被氧化成Y,反应可简单表示为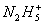 +4Fe3+
+4Fe3+ 4Fe2++Y+……,据此可知Y为(? )
4Fe2++Y+……,据此可知Y为(? )
A.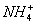
B.N2
C.N2O
D.N2H4
参考答案:B
本题解析: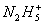 中N为-2价,设N升高到x价,根据电子得失守恒(x+2)×2=4×1解得x=0。
中N为-2价,设N升高到x价,根据电子得失守恒(x+2)×2=4×1解得x=0。
本题难度:简单
3、选择题 用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)?△H=-1160kJ/mol
下列说法正确的是
A.若用标准状况下4.48LCH4还原NO2生成N2和水蒸气,放出热量为173.4 kJ/mol
B.由反应①可推知CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)△H﹥-574kJ/mol
C.反应②中当4.48LCH4反应完全时转移的电子总数为1.60mol
D.反应①②转移的电子数相同
参考答案:D
本题解析:A、①+②得:2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g);ΔH=-1734? kJ/mol-1,将题给数据带入计算,放出热量的数值正确单位错误,错误;B、对比①和选项所给反应生成物水的状态不同,生成液态水放出的热量多,△H越小,错误;C、反应②中没有明确温度和压强,无法计算甲烷的物质的量,无法计算转移的电子数,错误;D、反应①和②中CH4?均被氧化为CO2转移电子数为8,正确。
本题难度:一般
4、选择题 对下列材料的特征及用途的说法不正确的是
A.玻璃纤维柔软如丝,可像棉纱一样纺织,但拉伸强度低
B.光导纤维传导光的能力很强,是非常好的通讯材料
C.氮化硅陶瓷耐高温且不易传热,可用于制造柴油机
D.玻璃钢强度高,密度小,耐腐蚀,可用于废水处理系统的管道
参考答案:A
本题解析:玻璃纤维不同于植物纤维,是一种高强度的新型材料。玻璃纤维虽然极细如丝,但其拉伸强度大,其拉伸强度接近于钢。显然A项错误。
本题难度:简单
5、填空题 抗击“非典”期间,过氧乙酸(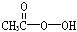 )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
①?□MnO4+□H2O2+□H+?═□Mn2++□O2十□H2O
②? H2O2+2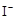 +2H+ ═?I2+2H2O
+2H+ ═?I2+2H2O
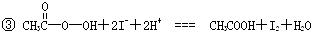
④ I2+2S2O32-═S4O62-+2I-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
□MnO-4+□H2O2+□H+ ═?□Mn2++□O2十□H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是_____________________。?
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·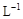 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·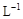 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ________________________。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 _______________(填是或否)
参考答案:(1)2MnO4-+5H2O2+6H+=2Mn2++5O2十8H2O
(2)淀粉溶液?(3)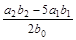 ?(4)否
?(4)否
本题解析:(1)根据方程式可知,Mn元素的化合价从+7价较低到+2价,得到5个电子。双氧水中氧元素的化合价从-1价升高到0价,失去1个电子,所以根据电子的得失守恒可知,氧化剂与还原剂的物质的量之比是2:5,则配平后的方程式是2MnO4-+5H2O2+6H+=2Mn2++5O2十8H2O。
(2)由于碘遇淀粉显蓝色,所以用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是淀粉溶液。
(3)根据反应①可知,溶液中双氧水的物质的量是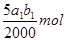 ,则根据反应②可知,双氧水和碘化钾反应生成的单质碘的物质的量是
,则根据反应②可知,双氧水和碘化钾反应生成的单质碘的物质的量是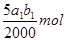 。根据反应④可知,反应中生成的单质碘的物质的量共计是
。根据反应④可知,反应中生成的单质碘的物质的量共计是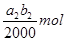 ,所以过氧乙酸与碘化钾反应生成的单质碘的物质的量是
,所以过氧乙酸与碘化钾反应生成的单质碘的物质的量是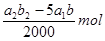 ,所以根据③反应可知,过氧乙酸的物质的量是
,所以根据③反应可知,过氧乙酸的物质的量是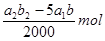 ,所以过氧乙酸的浓度是
,所以过氧乙酸的浓度是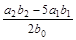 mol/L。
mol/L。
(4)根据(3)中的分析可知,测定结果与碘化钾的质量没有关系,所以不会影响结果。
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养与解题方法的指导与训练,有利于培养学生的逻辑推理能力,提高学生规范、严谨的实验设计能力。该题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般