微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将Fe和Cu的混合粉末加入到100 mL 4 mol/L稀硝酸中充分反应后:
(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是?,可能有的阳离子是?。
(2)若反应后的溶液中有Fe3+,则溶液中一定含有的阳离子是?,可能含有的阳离子是?。
(3)如果反应后的溶液中无金属剩余,则加入的金属质量最大为?。
(4)如果加入的Fe和Cu的质量比为7∶8,则使HNO3完全反应的金属最小质量为?。
参考答案:(1)Fe2+ Cu2+
(2)Cu2+ Fe2+或H+
(3)9.6 g
(4)7.2 g
本题解析:本题中要注意的是稀HNO3将铁和铜氧化时的反应顺序:①与Fe反应生成Fe3+;②与Cu反应生成Cu2+;③Fe3+与Fe反应生成Fe2+。(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是Fe2+,可能有的阳离子是Cu2+;(2)若反应后有Fe3+,则此溶液中一定有的阳离子是Cu2+,可能有的阳离子是Fe2+或H+,而这两者不能同时大量存在;(3)由上述的三个过程可知,只发生与铜的反应时所需的金属质量是最大的,由3Cu~8HNO3可解得需Cu的质量最大为9.6 g;(4)因要求金属质量要最小,所以加入的铁要尽量多地耗酸,所以生成的是Fe3+,加入的Fe与Cu的质量比为7∶8,得到两者的物质的量之比为1∶1,根据Fe~4HNO3,3Cu~8HNO3可解得需金属的物质的量各为0.06 mol,从而可得金属的质量为7.2 g。
本题难度:一般
2、选择题 由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生氯气。该混盐 (?)
A.水溶液呈中性
B.与硫酸反应产生1mol氯气时转移2mol电子
C.水溶液不能使淀粉-KI试纸变蓝
D.既含离子键又含共价键
参考答案:D
本题解析:混盐CaOCl2是由CaCl2与Ca(ClO)2组成的。CaCl2是强酸强碱盐,水溶液显中性,但是Ca(ClO)2是强碱弱酸盐,水解使水溶液显碱性。错误。B.与硫酸反应:CaOCl2+H2SO4=CaSO4+Cl2↑+H2O. 产生1mol氯气时转移1mol电子.错误。C.水溶液含有ClO-,该离子有强氧化性,能把I-氧化为I2,所以能使淀粉-KI试纸变蓝。错误。D.该盐是离子化合物,含有离子键。在ClO-中含有极性共价键,因此该化合物既含离子键又含共价键。正确。2的性质。
本题难度:一般
3、填空题 氧化还原反应中实际上包含?氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-?+4H++3e-===NO↑+2H2O KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:? ___________________________________。
(2)反应中硝酸体现了________、________性质。
(3)反应中若产生0.2?mol气体,则转移电子的物质的量是________mol。
(4)若1?mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是____________________________________________________________。
参考答案:(1)14HNO3+3Cu2O=== 6Cu(NO3)2+2NO↑+7H2O
(2)酸性;氧化性
(3)0.6
(4)使用了较浓的HNO3,产物中有部分NO2
本题解析:
本题难度:一般
4、选择题 已知镁和稀硝酸反应时,每有1mol HNO3反应,就有0.8mol电子转移,此时硝酸的还原产物可能是
A.NO2
B.N2O
C.N2O4
D.NO
参考答案:B
本题解析:在镁和稀硝酸的反应中有0.8mol电子转移,由Mg—2e—=Mg2+可知有0.4molMg参加反应,同时生成了0.4molMg(NO3)2,即在1mol HNO3中只有0.2molN原子被还原;也就是1mol N 原子失去了4 mol电子。可见还原产物中N的平均化合价为+1,即N2O或NH4NO3;相应的方程式为:
4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
4Mg+10HNO3=4Mg(NO3)2+N2O↑+5H2O
本题难度:一般
5、填空题 现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
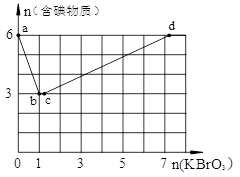
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为?。
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式? ________________________________________。
(3)n(KBrO3) = 4时,对应含碘物质的化学式为?。
参考答案:(1)1 : 6;(2)BrO3- + 5Br- + 6H+ = 3Br2 + 3H2O(3)I2,KIO3;
本题解析:(1)b点时,KI反应完全,n(KI):n(KBrO3)=6:1,反应中KI被氧化,KBrO3被还原,反应的方程式为6I-+BrO3-+6H+=3I2+Br-+3H2O,
(2)b→c过程中,含碘物质的物质的量没有发生变化,溶液中存在Br-和BrO3-,二者发生氧化还原反应,反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O,
(3)n(KBrO3)=4时,溶液中含碘物质的物质的量介于3~6之间,部分I2被氧化生成KIO3,
本题难度:一般