微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (13分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途。
(1)在定向爆破中,常利用氧化铁与铝反应放出的热量来切割钢筋,该反应的化学方程式为__。
(2)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s)?△H=+468.2 kJ·mol-1
C(s)+O2(g)=CO2(g) △H="-393.5" kJ·mol-1。
则Fe(s)与O2 (g)反应生成Fe2 O3 (s)的热化学方程式为______________________。
(3)可用KMnO4溶液滴定Fe2+的浓度,反应的离子方程式如下:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①KMnO4溶液应盛放在_____滴定管中;
②判断达到滴定终点的现象是_____;
③用硫酸酸化的0.020 00 mol·L-1。KMnO4溶液滴定某FeSO4溶液至终点,实验数据记录如下表:
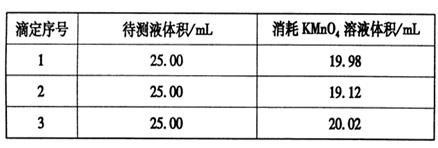
请分析数据并计算,该FeSO4溶液的物质的量浓度为_____。
(4)新型纳米材料ZnFe2Ox,可用于除去工业废气中的某些氧化物。制取新材料和除去废气的转化关系如下图:

①已知ZnFe2O4与H2反应的物质的量之比为2:1,则ZnFe2Ox中x=_____;
②用ZnFe2Ox除去SO2的过程中,氧化剂是_____。
参考答案:(1)Fe2O3+2Al Al2O3+2Fe (2)4Fe(s)+3O2 (g)=2Fe2O3(s) △H=-1648.7kJ/mol
Al2O3+2Fe (2)4Fe(s)+3O2 (g)=2Fe2O3(s) △H=-1648.7kJ/mol
(3)①酸式?②溶液恰好变浅紫红色,且半分钟内不褪色 ③0.080 00 mol·L-1
(4)①3.5?②SO2
本题解析:(1)氧化铁与铝反应发生的是铝热反应,方程式为Fe2O3+2Al Al2O3+2Fe;
Al2O3+2Fe;
(2)已知:①2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s)?△H=+468.2 kJ·mol-1、②C(s)+O2(g)=CO2(g) △H="-393.5" kJ·mol-1。则根据盖斯定律可知②×3-①即得到反应4Fe(s)+3O2 (g)=2Fe2O3(s),所以该反应的反应热△H=-393.5 kJ/mol×3-468.2 kJ/mol=-1648.7kJ/mol;
(3)①酸性KMnO4溶液具有强氧化性和酸性,应盛放在酸式滴定管中;
②由于酸性高锰酸钾溶液显紫红色,所以判断达到滴定终点的现象是溶液恰好变浅紫红色,且半分钟内不褪色;
③根据表中数据可知,第二次实验中消耗高锰酸钾溶液的体积与其余二次相差较大,舍去不用,因此消耗高锰酸钾溶液的体积平均值为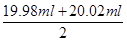 =20.00ml,所以根据方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知,FeSO4溶液的物质的量浓度为
=20.00ml,所以根据方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知,FeSO4溶液的物质的量浓度为 ×5=0.080 00 mol·L-1。
×5=0.080 00 mol·L-1。
(4)①已知ZnFe2O4与H2反应的物质的量之比为2:1,则根据原子守恒可知,反应中还生成1分子水,所以ZnFe2Ox中x=(4×2-1)÷2=3.5;
②在ZnFe2Ox中铁元素的化合价是+2.5价,而反应后变为+3价,化合价升高,失去电子,做还原剂,因此氧化剂是二氧化硫。
本题难度:困难
2、选择题 工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
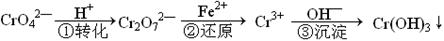
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O下列说法错误的是
Cr2O72—(橙色)+H2O下列说法错误的是
A.在第①反应平衡体系中加入水,溶液中c(H+)增大
B.溶液的pH值不变时,说明第①步反应达平衡状态
C.第②步中,还原0.01mol Cr2O72—离子,需要0.06mol的FeSO4·7H2O。
D.上述三步转化反应中,只有一个反应为氧化还原反应
参考答案:A
本题解析:A.在第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O。向该平衡体系中加入水,溶液中各种离子的浓度都减小。错误。符合题意。B.当该可逆反应达到平衡状态时,每种离子的浓度都不会发生变化,所以溶液的PH也就不变,因此可以说明第①步反应达平衡状态。正确,不符合题意。C.第②步中,由于Cr的化合价从反应前的+6价变为反应后的+3价,每个Cr达到3个电子,每1mol的Cr2O72—离子得到6mol的电子。现在还原0.01mol Cr2O72—离子,就要得到0.06mol的电子。而每mol的Fe2+变为Fe3+时只能失去1mol的电子,所以转移0.06mol的电子需要0.06mol的FeSO4·7H2O。正确,不符合题意。D.氧化还原反应的特征是化合价的升降,在第①步和第③步的转化中没有化合价的变化,不是氧化还原反应,在第②步中由化合价的变化,是氧化还原反应。因此正确但不符合题意。2O72—和CrO42—的处理原理的知识。
Cr2O72—(橙色)+H2O。向该平衡体系中加入水,溶液中各种离子的浓度都减小。错误。符合题意。B.当该可逆反应达到平衡状态时,每种离子的浓度都不会发生变化,所以溶液的PH也就不变,因此可以说明第①步反应达平衡状态。正确,不符合题意。C.第②步中,由于Cr的化合价从反应前的+6价变为反应后的+3价,每个Cr达到3个电子,每1mol的Cr2O72—离子得到6mol的电子。现在还原0.01mol Cr2O72—离子,就要得到0.06mol的电子。而每mol的Fe2+变为Fe3+时只能失去1mol的电子,所以转移0.06mol的电子需要0.06mol的FeSO4·7H2O。正确,不符合题意。D.氧化还原反应的特征是化合价的升降,在第①步和第③步的转化中没有化合价的变化,不是氧化还原反应,在第②步中由化合价的变化,是氧化还原反应。因此正确但不符合题意。2O72—和CrO42—的处理原理的知识。
本题难度:一般
3、选择题
⑴ 由钛铁矿(FeTiO3)提取金属钛(海绵钛)的主要工艺过程如下(部分产物省略):
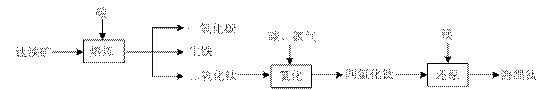
上述熔炼过程发生的反应为吸热反应,该反应能够自发进行的原因是?▲?;还原过程必须在1070K的温度下进行,你认为还应该控制的反应条件是?▲?。
⑵ 用浓硫酸处理钛铁矿,并向所得溶液中加入铁,此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物
| Fe(OH)2
| TiO(OH)2
| Mg(OH)2
|
Ksp
| 8.0×10-16
| 1.0×10-29
| 1.8×10-11
|
常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于?▲?时,Mg(OH)2开始沉淀。
 若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量?
若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量?
白色沉淀,写出该反应的离子方程式:?▲?。
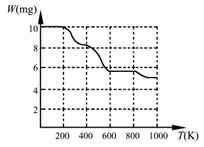
⑶ BaTiO3是一种可用来吸收低频波的无机功能材料。工业上,常用
BaCl2、TiCl4、H2O和H2C2O4混合反应生成白色固体A,将该白色
固体加热分解至900K可得BaTiO3,实验测得其热分解过程的质量
-温度关系曲线如右图所示,图中400K、600K和900K时对应的
样品的质量分别为8.38mg、5.68mg和5.19mg。白色固体A的化学式
为?▲?(填序号)。
a.BaTi2O5?b.BaC2O4·2H2O?c.BaTi(C2O4)3?d.BaTiO (C2O4)2·4H2O
参考答案:⑴ 熵变大于零(△S>0)?隔绝空气
⑵ 10? TiO2++2H2O=TiO(OH)2↓+2H+
⑶ d
本题解析:本题通过钛及其化合物的制备与应用为背景素材,考查学生运用化学理论知识解决工业实际问题的能力以及对图表、图示的观察、分析、运用和数据处理能力。
⑴化学反应的发生至少必须满足“焓变小于零、熵变大于零”中的一个;反应控制在隔绝空气(或在惰性环境中进行)的条件下进行,是考虑到金属镁与空气中氧气、氮气、二氧化碳的反应(钛的性质、四氯化钛的水解等知识学生不熟悉)。⑵第一问主要考查Ksp与pH的简单计算,第二问由于TiO(OH)2的Ksp最小,故最容易水解。⑶依据M[BaTiO (C2O4)2·4H2O]:M(BaTiO3)=10.00:5.19,可知白色固体A的化学式为BaTiO (C2O4)2·4H2O。
本题难度:一般
4、选择题 现取m g镁铝合金在一定浓度的稀硝酸中恰好完全溶解(硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol·L-1 NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中正确的有( )。
①沉淀中OH-的质量为(n-m)g
②恰好溶解后溶液中的NO3—的物质的量为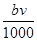 ?mol
?mol
③反应过程中转移的电子数为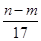 ?mol
?mol
④标准状况下生成NO的体积为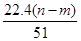 L
L
⑤与合金反应的硝酸的物质的量为(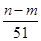 +
+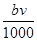 )mol
)mol
A.5项
B.4项
C.3项
D.2项
参考答案:A
本题解析:本题涉及的反应有Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O;3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O;Al(NO3)3+3NaOH=Al(OH)3↓+3NaNO3;Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3。当合金恰好溶解时,溶液中的NO3—与Na+的物质的量相等,n(NO3—)=n(NaOH)=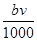 ?mol,故②正确。沉淀质量最大时,生成的n g沉淀为氢氧化铝和氢氧化镁,根据质量守恒定律,其中镁、铝元素的质量等于m g,所以沉淀中氢氧根的质量为(n-m)g,则反应过程中转移的电子物质的量n(e-)=n(OH-)=
?mol,故②正确。沉淀质量最大时,生成的n g沉淀为氢氧化铝和氢氧化镁,根据质量守恒定律,其中镁、铝元素的质量等于m g,所以沉淀中氢氧根的质量为(n-m)g,则反应过程中转移的电子物质的量n(e-)=n(OH-)=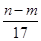 mol,故①,③正确。根据电子得失守恒知,标准状况下V(NO)=
mol,故①,③正确。根据电子得失守恒知,标准状况下V(NO)=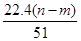 ?L,故④正确。参加反应的硝酸有两种作用,起酸性作用的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,即
?L,故④正确。参加反应的硝酸有两种作用,起酸性作用的硝酸(生成硝酸盐)的物质的量等于硝酸钠的物质的量,即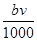 ?mol;作氧化剂的硝酸的物质的量等于NO的物质的量,即
?mol;作氧化剂的硝酸的物质的量等于NO的物质的量,即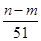 ?mol,所以,与合金反应的硝酸的物质的量为(
?mol,所以,与合金反应的硝酸的物质的量为(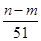 +
+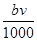 )mol,故⑤正确。
)mol,故⑤正确。
本题难度:一般
5、选择题 将一定质量铜与100 mL一定浓度的硝酸反应,铜完全溶解时产生的NO和NO2混合气体在标准状况下的体积为11.2 L。待产生的气体全部释放后,向溶液加入140 mL 5 mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度是
A.5 mol/L
B.7 mol/L
C.10 mol/L
D.12 mol/L
参考答案:D
本题解析:在Cu与硝酸的反应中Cu失去电子变为Cu2+,硝酸得到电子变为NO和NO2混合气体,向反应后的溶液中加入OH-后,发生反应:Cu2++2OH-=Cu(OH)2↓.消耗的OH-的个数与硝酸铜中的硝酸根离子的个数相等。所以反应过程中消耗的硝酸的物质的量为n(HNO3)=n(气体)+n(NO3-)=" 11.2L÷22.4L/mol+" 0.14L×5 mol/L="0." 5mol+0.7mol=1.2mol.所以C(HNO3)=1.2mol÷0.1L=12mol/L.选项为D.
本题难度:一般