微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质的溶液在蒸发皿加热蒸干、灼烧,可以得到该物质固体的是
A.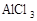
B.
C.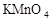
D.
参考答案:D
本题解析: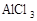 的溶液在蒸发皿加热蒸干、灼烧得到Al2O3 ,
的溶液在蒸发皿加热蒸干、灼烧得到Al2O3 ,  ?的溶液在蒸发皿加热蒸干、灼烧得到 Na2SO4 ..
?的溶液在蒸发皿加热蒸干、灼烧得到 Na2SO4 ..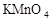 ?加热分解。
?加热分解。
本题难度:一般
2、填空题 (1)AgNO3的水溶液呈?(填“酸”、“中”、“碱”)性,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度.以?(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈?性,原因是(用离子方程式表示):_____________________
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是?
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的??。原因是:_________________(用离子方程式表示);
参考答案:(1)酸,抑制。(2)酸,Al3++3H2O 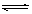 ?Al(OH)3+3H+, Al2O3?;
?Al(OH)3+3H+, Al2O3?;
(3)NaOH。S2-+H2O HS-+OH-?HS-+H2O
HS-+OH-?HS-+H2O H2S+OH-
H2S+OH-
本题解析:(1)硝酸银是强酸弱碱盐,所以AgNO3的水溶液呈酸性;硝酸中氢离子浓度大,所以将AgNO3固体先溶于较浓的硝酸中,可以抑制硝酸银的水解。
(2)氯化铝是强酸弱碱盐,水解显酸性,反应的方程式是Al3++3H2O 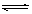 ?Al(OH)3+3H+;由于水解是吸热的,所以加热可以促进水解,同时生成的氯化氢极易挥发,所以最终生成的是氢氧化铝,灼烧得到氧化铝。
?Al(OH)3+3H+;由于水解是吸热的,所以加热可以促进水解,同时生成的氯化氢极易挥发,所以最终生成的是氢氧化铝,灼烧得到氧化铝。
(3)硫化钠是强碱弱酸盐,硫离子水解显碱性,所以加入少量的氢氧化钠可以抑制硫化钠的水解,有关反应的方程式是S2-+H2O HS-+OH-?、HS-+H2O
HS-+OH-?、HS-+H2O H2S+OH-。
H2S+OH-。
点评:在判断盐溶液的酸碱性时,需要掌握盐类水解的原理及水解的特点。盐类水解遵循:有弱才水解、无弱不水解、都弱都水解,越弱越水解,谁强显谁性。
本题难度:一般
3、选择题 下列有关物质浓度关系的描述,正确的是? ( )。
A.25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1
B.25 ℃时,向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42—)>c(OH-)=c(H+)
C.0.1 mol·L-1NaHCO3溶液中:c(OH-)+2c(CO32—)=c(H+)+c(H2CO3)
D.同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3)
参考答案:AD
本题解析:25 ℃时,NaB溶液中根据电荷守恒可得:c(Na+)+c(H+)=c(B-)+c(OH-),则c(Na+)-c(B-)=c(OH-)-c(H+),根据NaB溶液的pH=8,则pOH=6,故c(Na+)-c(B-)=c(OH-)-c(H+)=1×10-6mol·L-1-1×10-8mol·L-1=9.9×10-7mol·L-1,A正确;向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液,首先发生的反应是2NH4HSO4+2NaOH===(NH4)2SO4+Na2SO4+2H2O,此时c(SO42—)=c(NH4+),但因为(NH4)2SO4是强酸弱碱盐,溶液呈酸性,若欲使溶液呈中性,则少量(NH4)2SO4继续与NaOH反应生成NH3·H2O,所以离子浓度关系应为c(Na+)>c(SO42—)>c(NH4+)>c(OH-)=c(H+),B错误;0.1 mol·L-1的NaHCO3溶液中,电荷守恒式为c(OH-)+2c(CO32—)+c(HCO3—)=c(H+)+c(Na+),物料守恒式为c(Na+)=c(CO32—)+c(HCO3—)+c(H2CO3),所以c(OH-)+c(CO32—)=c(H+)+c(H2CO3),C错误;因为酸性:CH3COOH>H2CO3>C6H5OH>HCO3—,则它们对应盐的水解程度c(CH3COONa)<c(NaHCO3)<c(C6H5ONa)<c(Na2CO3),所以同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3),D正确。
本题难度:一般
4、选择题 一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O CH3COOH+OH-,下列说法正确的是
CH3COOH+OH-,下列说法正确的是
A.加入少量NaOH固体,c(CH3COO-)减小
B.加入少量FeCl3固体,c(CH3COO-)减小
C.稀释溶液,溶液的pH增大
D.加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
参考答案:B
本题解析:
正确答案:B
A.不正确,加入少量NaOH固体,水解平衡逆向移动,c(CH3COO-)减大;
B.正确,加入少量FeCl3固体,水解呈酸性,促进CH3COO―水解c(CH3COO-)减小
C.不正确,稀释溶液,促进水解,溶液的pH减小;
D.不正确,加入适量醋酸,得到的酸性混合溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
本题难度:一般
5、填空题 BiCl3水解产物中有BiOCl生成。
(1)写出水解反应方程式______________________。
(2)医药上将BiOCl称为次氯酸铋,该名称____________(填“正确”“不正确”)。
(3)如何配制BiCl3溶液?
参考答案:(1)BiCl3+H2O====BiOCl+2HCl
(2)不正确
(3)将适量的BiCl3固体溶于少量浓盐酸,再加水稀释。
本题解析:因为BiCl3+H2O BiOCl+2HCl,所以在配制BiCl3溶液时要防止其水解,方法是将BiCl3溶解在少量浓盐酸中,然后加水稀释即可。因为在BiOCl中氯元素的化合价为-1,而在HClO中氯元素的化合价为-1,故将BiOCl称为次氯酸铋不正确。
BiOCl+2HCl,所以在配制BiCl3溶液时要防止其水解,方法是将BiCl3溶解在少量浓盐酸中,然后加水稀释即可。因为在BiOCl中氯元素的化合价为-1,而在HClO中氯元素的化合价为-1,故将BiOCl称为次氯酸铋不正确。
本题难度:简单