微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

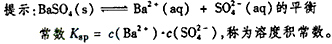
[? ]
A. 加入Na2SO4可以使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. a点对应的Ksp大于c点对应的Ksp
D. d点无BaSO4沉淀生成
参考答案:D
本题解析:
本题难度:一般
2、填空题 从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
物质
| CaCO3
| MgCO3
| Ca(OH)2
| Mg(OH)2
|
溶度积
| 2.8×10–9
| 6.8×10–6
| 5.5×10–6
| 1.8×10–11
|
?
(1)在从海水中提取镁时,往往用到贝壳(主要成份是碳酸钙),你认为?(填“能”或“不能”)将贝壳研磨成粉末直接投入海水中,理由是?;如果不能直接投入,应将贝壳作何处理,试写出化学方程式?。
(2)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为?(填“可以”或“不可以”)得到Mg(OH)2。在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他?(填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是?(用离子方程式表示)。
(3)已知海水中镁离子浓度为1.8×10–3mol·L–1,则要使镁离子产生沉淀,溶液的PH最低应为?。
参考答案:(1)不能(1分);?贝壳研磨成粉末仍是CaCO3,CaCO3的溶解度比MgCO3的溶解度小,所以将其直接投入海水中不能产生MgCO3(2分);? CaCO3 CaO + CO2↑(2分);? (2)可以(1分);
CaO + CO2↑(2分);? (2)可以(1分);
能(1分);? CO32– + Mg2+ = MgCO3、MgCO3 + 2OH– = Mg(OH)2 + CO32–(4分)? (3)10(2分)
本题解析:(1)贝壳研磨成粉末仍是CaCO3,CaCO3的溶度积比MgCO3的溶度积小,所以将其直接投入海水中不能产生MgCO3;应将贝壳煅烧成CaO,CaO投入海水中生成的Ca(OH)2使海水中的Mg2+转化为Mg(OH)2沉淀。(2)NaOH电离出的OH–可与Mg2+反应生成Mg(OH)2沉淀。Mg(OH)2的溶度积MgCO3的溶度积,可以通过与烧碱反应把MgCO3沉淀转化为Mg(OH)2沉淀:MgCO3 + 2OH– = Mg(OH)2 + CO32–。(3)Ksp[Mg(OH)2]=c(Mg2+)·c2(OH–)=1.8×10–3·c2(OH–)=1.8×10–11,可求得c(OH–)=1×10–4,故pH=10。
本题难度:一般
3、选择题 氯化银在水中存在AgCl(s) 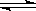 ?Ag+(aq)+Cl-(aq)溶解平衡,现将足量氯化银分别放入同温下的:①100mL蒸馏水中,②100mL0.1mol·L-1盐酸中,③100mL0.1mol·L-1氯化铝溶液中,④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,银离子浓度由大到小的顺序是
?Ag+(aq)+Cl-(aq)溶解平衡,现将足量氯化银分别放入同温下的:①100mL蒸馏水中,②100mL0.1mol·L-1盐酸中,③100mL0.1mol·L-1氯化铝溶液中,④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,银离子浓度由大到小的顺序是
A.①②③④
B.③④①②
C.①②④③
D.③④②①
参考答案:C
本题解析:氯离子浓度越大,平衡向逆向移动,银离子浓度就越小。氯离子浓度③>④>②>①;故银离子浓度为①>②>④>③。
本题难度:简单
4、选择题 下列有关沉淀溶解平衡的说法中,正确的是(?)
A. Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中加入蒸馏水,氯化银的Ksp增大
C.在碳酸钙的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动
D.向氯化银沉淀溶解平衡体系中加人碘化钾固体,氯化银沉淀可转化为碘化银沉淀
参考答案:D
本题解析:A 错 Ksp越小,溶解度越大
B 错 Ksp只与温度有关系
C错 加入稀盐酸,和碳酸钙,平衡移动
D 对 氯化银沉淀会转变成更难溶的碘化银沉淀
本题难度:简单
5、选择题 在一混合溶液中含有KCl、KBr、K2CrO4,其浓度均为0.01 mol·L-1,向溶液中逐滴加入0.01 mol·L-1
AgNO3溶液时,最先和最后沉淀的物质是
(AgCl、 AgBr、 Ag2CrO4的Ksp分别为1.77×10-10、5.35×10-13、1.12×10-12)
[? ]
A.AgBr、AgCl
B.Ag2CrO4、AgCl
C.AgBr、Ag2CrO4
D.同时沉淀
参考答案:C
本题解析:
本题难度:一般