微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (16分)硅孔雀石是一种含铜的矿石,含铜形态为CuCO3?Cu(OH)2和CuSiO3?2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下:
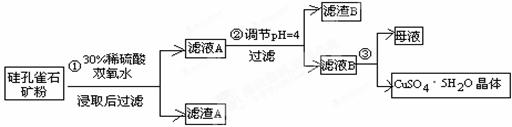
(1)步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式: ;
用离子方程式表示双氧水的作用_______________________________________。
(2)步骤②调节溶液pH选用试剂不可以是__________________
a.CuO b.Cu (OH)2 c.Cu2(OH)2CO3 d.CuSO4
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Cu(OH)2
|
开始沉淀的pH
| 3.3
| 1.5
| 6.5
| 4.2
|
沉淀完全的pH
| 5.2
| 3.7
| 9.7
| 6.7
|
由上表可知当溶液pH=4时,可以完全除去的离子是______(填金属离子符号,后同),不能完全除去的离子是________。
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶、洗涤可以得到CuSO4?5H2O晶体。某同学认为上述操作会有硫酸铝晶体析出。请你结合相关数据,通过计算对该同学的观点予以评价 (填“正确”、“不正确”、或“无法判断”)
【已知常温下,Al2(SO4)3饱和溶液中c(Al3+)=2.25mol/L,Ksp[Al(OH)3]=3.2×10-34】
(5)测定硫酸铜晶体(CuSO4?5H2O)里结晶水的含量,实验步骤为:a.研磨;b.称量空坩埚和装有试样的坩埚的质量;c.灼烧;d.干燥器中冷却;e.称量;f.重复c至e的操作,直到连续两次称量的质量差不超过0.1g为止;⑦根据实验数据计算硫酸铜结晶水的含量。
①步骤c用到的仪器有酒精灯、三脚架、泥三角、玻璃棒、 、 。
②步骤f的目的是 。
③如灼烧后在空气中冷却再称量,结晶水的测定结果会____(填“偏高”、“低”或“不变”)
参考答案:(1)CuSiO3?2H2O+H2SO4=CuSO4 + H4SiO4↓+H2O (或CuSiO3?2H2O+H2SO4=CuSO4 + H2SiO3↓+2H2O);2Fe2+ + H2O2 +2H+=2Fe3+ + 2H2O
(2)d
(3)Fe3+ ; Al3+
(4)不正确; 依题意常温下滤液B的pH=4,则c(OH-)=1×10-10 mol·L-1,此时Al3+已部分沉淀,溶液中有:c(Al3+)? c3(OH-) = Ksp[Al(OH)3] 即c(Al3+)?(1×10-10)3 = 3.2×10-34 c(Al3+) =3.2×10-4mol·L-1积浓缩为原来的一半后c(Al3+) =6.4×10-4mol·L-1<<2.25mol·L-1 所以不会有硫酸铝晶体析出
(5)①坩埚、坩埚钳
②确保样品中的结晶水已经全部除去,以免引起实验误差
③偏低
本题解析:(1)在硅孔雀石矿粉中加入稀硫酸和双氧水,其中稀硫酸与CuSiO3·2H2O发生反应的化学方程式为CuSiO3?2H2O+H2SO4=CuSO4 + H4SiO4↓+H2O;双氧水的作用是将二价铁氧化为三价铁,离子方程式为2Fe2+ + H2O2 +2H+=2Fe3+ + 2H2O;
(2)调节溶液pH选用试剂不可以是硫酸铜;
(3)由表中数据可知,当溶液的pH=4时,Al(OH)3还没有沉淀完全,而Fe(OH)3已完全沉淀,故可以完全除去的离子是Fe3+,不能完全除去的离子是Al3+;
(4)滤液B通过蒸发浓缩,体积浓缩为原来的一半,、冷却结晶、洗涤可以得到CuSO4?5H2O晶体,不会有硫酸铝晶体析出,依题意常温下滤液B的pH=4,则c(OH-)=1×10-10 mol·L-1,此时Al3+已部分沉淀,溶液中有:c(Al3+)? c3(OH-) = Ksp[Al(OH)3] 即c(Al3+)?(1×10-10)3 = 3.2×10-34,c(Al3+) =3.2×10-4mol·L-1,体积浓缩为原来的一半后c(Al3+) =6.4×10-4mol·L-1<<2.25mol·L-1,所以不会有硫酸铝晶体析出;
(5)①在灼烧的过程中需要的仪器为酒精灯、三脚架、泥三角,玻璃棒、坩埚、坩埚钳;②重复c至e的操作的目的是确保样品中的结晶水已经全部除去,以免引起实验误差;③将灼烧后在空气中冷却再称量,晶体会吸收空气中的水分,使结晶水的测定结果偏低。
考点:化学反应方程式、离子方程式的书写,实验过程的评价
本题难度:困难
2、选择题 下列说法不正确的是
[? ]
A.向纯水中加入盐酸使水的电离平衡逆向移动,水的离子积减小?
B.反应NH3(g)+HCl(g)==NH4Cl(s)?△H<0,低于一定温度自发,高于一定温度非自发
C.铅蓄电池在放电过程中,负极质量减少,正极质量增加
D.用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3?
参考答案:AC
本题解析:
本题难度:一般
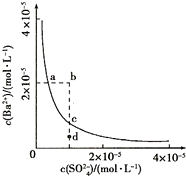
3、选择题 常温下,CaSO4在水中的沉淀溶解平衡曲线如下图所示,Ksp(CaSO4)= 9.0×10-6。下列说法中正确的是

[? ]
A.通过蒸发可以使溶液由d点变到c点
B.a点对应的Ksp等于c点对应的Ksp
C.常温下CaSO4饱和溶液中,c(Ca2+)、c(SO42-)对应曲线上任意一点
D.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L
参考答案:B
本题解析:
本题难度:一般
4、简答题 难溶性杂卤石(K2SO4?MgSO4?2CaSO4?2H2O)属于“呆矿”,在水中存在如下平衡
K2SO4?MgSO4?2CaSO4?2H2O(s)?2Ca2++2K++Mg2++4
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:
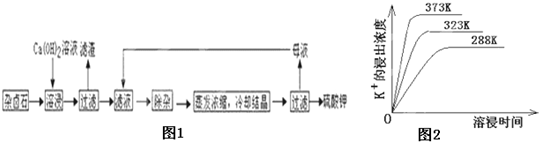
(1)滤渣主要成分有______和______以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:______.
(3)“除杂”环节中,先加入______溶液,经搅拌等操作后,过滤,再加入______溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①______②______;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+?CaCO3(s)+
已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K______?(计算结果保留三位有效数字).
参考答案:(1)“呆矿”,在水中存在沉淀溶解平衡:K2SO4?MgSO4?2CaSO4?2H2O(s)?2Ca2++2K++Mg2++4SO42-+2H2O,为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,氢氧根离子和镁离子结合生成氢氧化镁沉淀,同时钙离子增多,析出氢氧化钙沉淀,所以滤渣中主要成分为Ca(OH)2,Mg(OH)2,故答案为:Ca(OH)2;Mg(OH)2;
(2)Ca(OH)2溶液能溶解杂卤石浸出K+的原因是氢氧化钙是饱和溶液,加入后氢氧根离子和镁离子结合生成氢氧化镁沉淀,促进平衡右移钙离子增多,饱和溶液中析出氢氧化钙,增多K+,故答案为:氢氧根与镁离子结合使平衡向右移动,钾离子变多;
(3))“除杂”环节主要是除去钙离子,依据除杂原则不能引入新的杂质,根据制取的目的是制备硫酸钾,所以加入的试剂易于除去,不引入新的杂质,因此加入过量K2CO3除钙离子,过滤后加入硫酸至中性,除去碳酸钾,故答案为:K2CO3;H2SO4;
(4)分析不同温度下,K+的浸出浓度与溶浸时间的关系,温度越高K+的浸出浓度越大,溶浸时间越短,反应速率越大,达到平衡越快,故图象中分析得到的结论为:温度越高,在同一时间K+的浸出浓度大;反应速率加快,平衡时溶浸时间短,
故答案为:在同一时间K+的浸出浓度大;反应速率加快,平衡时溶浸时间短;
(5)溶浸过程中会发生:CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq),CaCO3(s)=Ca2++CO32-;CaSO4(s)=Ca2++SO42-;依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算,反应的平衡常数K=C(SO42-)C(CO3-2)=Ksp(CaSO4)Ksp(CaCO3)=4.90×10-52.80×10-9=1.75×104,故答案为:1.75×104.
本题解析:
本题难度:一般
5、选择题 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )
A.d点无BaSO4沉淀生成
B.通过蒸发可以使溶液由d点变到c点
C.加入Na2SO4可以使溶液由a点变到b点
D.a点对应的Ksp等于c点对应的Ksp