微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设某元素某原 子核内的质子数为m,中子数为n,则下述论断正确的是
子核内的质子数为m,中子数为n,则下述论断正确的是
A.不能由此确定该元素的原子量
B.这种元素的原子量为m+n
C.若碳原子质量为W克,此原子的质量为(m+n)W克
D.核内中子和质子共同决定元素种类
参考答案:A
本题解析:略
本题难度:一般
2、选择题 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是
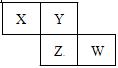
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:W>Z
C.Z的单质与氢气反应较Y的单质与氢气反应剧烈
D.X、Y形成的化合物都易溶于水
参考答案:B
本题解析:略
本题难度:一般
3、选择题 下列叙述正确的是(?)
A.碱金属单质在空气中燃烧的生成物都是过氧化物
B.少量的碱金属单质都能保存在煤油中
C.HF、HCl、HBr、HI还原性从左到右依次减弱
D.AgCl、AgBr、AgI的颜色由浅到深
参考答案:D
本题解析:Li在空气中燃烧生成氧化锂,Li没有过氧化物,A不正确;Li的密度小于煤油的,不能放在煤油中,应该密封在石蜡中,B不正确;非金属性越强,相应阴离子的还原性越弱,C不正确,HF、HCl、HBr、HI还原性从左到右依次增强,所以正确的答案选D。
点评:该题是高考中的常见题型,侧重对学生灵活运用元素周期律解决实际问题的能力的培养,有利于调动学生的学习兴趣和学习积极性,提高学生的应试能力。该题需要注意的是在在共性的前提下,还需要注意个性的不同。
本题难度:一般
4、选择题 下列说法错误的是( )
A.ns电子的能量不一定高于(n-1)p电子的能量
B.6C的电子排布式1s22s22p违反了洪特规则
C.电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理
D.电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理
参考答案:A
本题解析:A错,根据构造原理,原子核外电子排布为:
1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d,7p,所以ns电子的能量一定高于(n-1)p电子的能量;B正确,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同,这一规则称为洪特规则;C正确,能量最低原理即指原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。D正确,泡利原理是指在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,这个原理称为泡利原理。
本题难度:一般
5、选择题 下列中各组性质的比较,正确的是( )
①酸性:HClO4>HBrO4>HIO4?②离子还原性:S2->Cl->Br ->I-?③沸点:HF>HCl>HBr>HI
④金属性:K>Na>Mg>Al?⑤气态氢化物稳定性:HF>HCl>H2S?⑥半径:O2->Na+>Na>Cl
A.①②③
B.②③④
C.①④⑤
D.①②③④⑤⑥
参考答案:C
本题解析:①根据同主族元素性质递变规律判断,非金属性:Cl>Br>I,最高价氧化物水化物的酸性:HClO4>HBrO4>HIO4,正确;②根据非金属性活动顺序判断,非金属性:Cl>Br>I>S,离子还原性:S2->I- >Br - >Cl-,错误;③组成和结构相似的分子晶体,相对分子质量越大,沸点越高,HF分子间存在氢键,沸点反常的高,故沸点:HF>HI>HBr>HCl,错误;④根据同周期元素由左向右金属性逐渐减弱,同主族元素由上到下金属性增强知,金属性:K>Na>Mg>Al,正确;⑤根据非金属性活动顺序判断,非金属性:F>Cl>S ,气态氢化物稳定性:HF>HCl>H2S,正确;⑥半径:Na>Cl> O2->Na+,错误,选C。
本题难度:一般