| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《原电池原理》答题技巧(2017年最新版)(八)
参考答案:C 本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,则根据装置图可知,锌是负极,失去电子;铜是正极,溶液中的氢离子在正极得到电子,发生还原反应生成氢气。原电池是将化学能转化为电能的装置,所以正确的答案选C。 本题难度:一般 2、选择题 按如图所示装置进行下列不同的操作,其中不正确的是( ) |
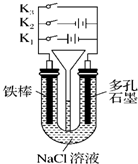
参考答案:A.只接通K1时,该装置是电解池,铁作阳极,腐蚀最快,只闭合K3时,该装置构成原电池,铁作负极发生吸氧腐蚀,腐蚀较快,只闭合K2时,该装置构成电解池,铁作阴极而被保护,所以铁腐蚀的速度由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2,故A正确;
B.只接通K1,该装置是电解池,阳极上铁失电子生成亚铁离子,阴极上氢离子放电,同时阴极附近生成氢氧根离子,亚铁离子和氢氧根离子反应生成灰白色氢氧化亚铁沉淀,所以一段时间后,U形管中出现白色沉淀,故B正确;
C.只接通K2,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,所以左右两端都有气体生成,压强增大导致U型管液面均下降,故C正确;
D.只接通K1,阴极上氢离子放电生成氢气导致U型管右端液面下降,则漏斗内液面上升,只接通K2,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,所以左右两端都有气体生成,压强增大导致U型管液面均下降,漏斗内液面上升,故D错误;
故选D.
本题解析:
本题难度:简单
3、简答题 从化工厂铬渣中提取硫酸钠的工艺如下: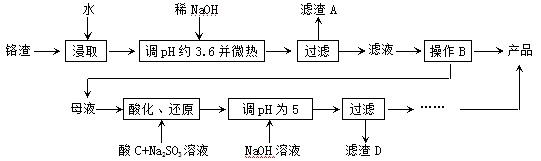
已知:①铬渣含有Na2SO4及少量Cr2O72-、Fe3+;②Fe3+、Cr3+完全沉淀(c ≤1.0×10-5mol·L-1)时pH分别为3.6和5。
(1)“微热”除能加快反应速率外,同时还可以?,滤渣A为?(填化学
式)。
(2)根据溶解度(S)∽温度(T)曲线,操作B的最佳方法为?(填
字母序号)
A.蒸发浓缩,趁热过滤? B.蒸发浓缩,降温结晶,过滤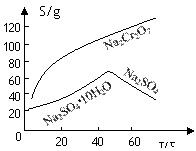
(3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为:
?;酸C为?,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=?。
(4)根据2CrO42-+2H+  ?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的?极,其电极反应式为?。
?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的?极,其电极反应式为?。
参考答案:(1)促进Fe3+水解生成Fe(OH)3而除去;Fe(OH)3
(2)A
(3)3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;H2SO4;1.0×10-32mol/L
(4)正极 ,4OH--4e-=O2+2H2O
本题解析:(1)盐类的水解反应是吸热反应,所以微热能促进Fe3+水解生成Fe(OH)3而除去,A为Fe(OH)3;
(2)根据溶解度曲线,可以看出温度较高时,随着温度的升高,Na2SO4的逐渐减少,所以采用蒸发浓缩,趋热过滤的 方法,所以A正确;
(3)酸化后,3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;因为最终产品是Na2SO4,为避免产生杂质,酸C为?酸;恰好完全沉淀时离子深度为c ≤1.0×10-5mol·L-1,Cr3+完全沉淀时pH=5,c(OH-)=1.0×10-9mol·L-1,所以Cr(OH)3的浓度积常数为Ksp=1.0×10-5×1.0×10-9)3=1.0×10-32
(4)根据示意图知,图中右侧Na2CrO4转化为Na2Cr2O7,需要H+,说明右侧电极发生OH-放电,使H2O的电离平衡向右移动,H+增多,所以右侧电极是连接电源的正极,电极方程式为4OH--4e-=O2+2H2O
本题难度:一般
4、选择题 右图为番茄制作的水果电池,下列说法正确的是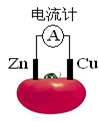
A.一段时间后,铜片质量减小
B.锌电极发生氧化反应
C.电流由锌通过导线流向铜
D.铜电极是该电池的负极
参考答案:B
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌的金属性强于铜的,所以锌是负极,铜是正极,溶液中的氢离子在正极得到电子生成氢气,所以选项B正确,其余选项都是错误的,答案选B。
点评:该题是基础性试题的考查,试题注重基础,贴近生活,有利于调动学生的学习积极性。该题的关键是明确原电池的工作原理,特别是正负极的判断以及和电极反应式的书写。
本题难度:一般
5、选择题 表明金属甲比金属乙活动性强的叙述是
A.氧化还原反应中,甲失电子数比乙多
B.同价态阳离子甲比乙氧化性强
C.甲能与浓硝酸反应放出气体而乙不能
D.将甲、乙与H2SO4溶液形成原电池,乙上冒气泡
参考答案:D
本题解析:金属的活动性体现失电子的能力,与失电子的数目无关;同价态阳离子的氧化性越强,对应金属的活动性越弱.
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《物质的组成.. | |