| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《原电池原理》答题技巧(2017年最新版)(六)
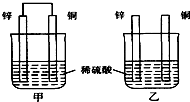 参考答案:A、甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误; 本题解析: 本题难度:一般 2、选择题 在理论上不能用于设计原电池的化学反应是 参考答案:A 本题解析: 本题难度:简单 3、填空题 (17分)I.工业上有一种用CO2来生产甲醇燃料的方法: |
参考答案:Ⅰ(1)大于? 1/2 (2)? A? (3) 升高温度?增大压强?增大?Ⅱ淀粉溶液,H2S04溶液? 4H+4I-+O2=2I2+2H2O
Ⅲ (1)Ag、Cu? (2)Pb? PbSO4-2e-+2H2O=PbO2+SO42-+4H+? B? (3) 890
本题解析:Ⅰ(1)a点氢气的物质的量还是在减小的,所以反应是在向正反应方向进行,因此正反应速率大于逆反应速率。平衡时氢气是2mol,则消耗氢气是6mol,所以同时消耗CO2是2mol,生成甲醇和水蒸气是2mol。所以平衡常数等于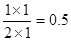 。
。
(2)反应速率越大,反映在曲线上斜率就越大,所以反应速率最大的是O~1 min,即A是正确的。
(3)根据图像可知曲线I对应的反应速率快,平衡时氢气的物质的量大,说明平衡是向逆反应方向移动的,因此改变的条件是升高温度。曲线Ⅱ的反应速率也快,但平衡时氢气的物质的量小,说明向正反应方向移动,因此是增大压强。体积不变再充入3molCO2和4 mol H2,相当于增大压强,平衡向正反应方向移动,所以水蒸气的含量增大。
Ⅱ.由于碘离子易被氧化,碘遇淀粉显蓝色,所以加入的顺序是淀粉溶液、H2S04溶液。方程式为4H+4I-+O2=2I2+2H2O。
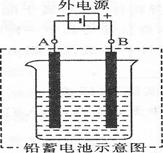
Ⅲ.(1)银和铜的金属性弱于镍的,所以阳极中的主要单质是铜和银。
(2)A和电源的负极相连,是阴极,电极产物是铅。B和电源的正极相连,是阳极,电极反应式为PbSO4-2e-+2H2O=PbO2+SO42-+4H+。B极产生二氧化铅,所以B是正极。
(3)l g水蒸气转化成液态水放热2.445 kJ,所以1mol水蒸气转化成液态水放热是2.445kJ×18=44.01kJ。生成1mol水蒸气放出的热量是401kJ,所以生成1mol液态水放出的热量是401kJ+44.01kJ=445.01kJ,所以甲烷的燃烧热是445.01kJ×2mol=890kJ/mol。
本题难度:一般
4、选择题 下列有关电化学的示意图正确的是(?)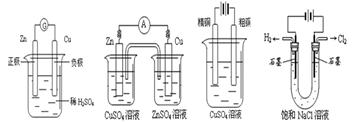
A? B?C (电解精炼铜) D
参考答案:D
本题解析:A中Zn为负极,Cu为正极。B中两个半电池应该是Zn—ZnSO4、Cu—CuSO4。C中电解精炼铜粗铜为阳极,精铜为阴极。
点评:考查电化学的示意图,难度一般,解题的技术是要认清原电池和电解池,正负极材料的选择。
本题难度:简单
5、填空题 因“召回门”而闹得沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1mol水蒸气放 热569.1 kJ。则该反应的热化学方程式为___________________
(2)混合动力车的电动机目前一般使用的是镍氢电池, 镍氢电池采用镍的化合物为正极,储氢金属(以M 表示)为负极,碱液(主要为KOH)为电解液。
①镍氢电池充放电原理如图所示(图中MH为吸附了氢原子的储氢合金),其总反应式是____________________。 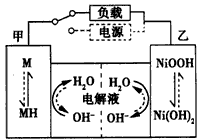
②根据所给信息判断,混合动力车下坡或刹车时,甲电极的电极反应式为_________________;混合动力车上坡或加速时,乙电极的电极反应式为____________________
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:CO(g) +1/2O2(g) CO2(g)
CO2(g)
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所 示。请填写表中的空格。

参考答案:(1)C8H18(l) +25/2O2(g)= 8CO2(g) +9H2O(g) △H=-5121.9 kJ/mol
(2)①MH+NiOOH M+Ni(OH)2;②M+H2O+e-=MH+OH-;NiOOH+H2O+e-= Ni(OH)2+OH-
M+Ni(OH)2;②M+H2O+e-=MH+OH-;NiOOH+H2O+e-= Ni(OH)2+OH-
(3)①v(正)<v(逆);②1.1×10-6
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《物质的组成.. | |