微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)请判断下列说法是否正确(填“对”或“错”)。
(1)碱性锌锰电池是一次电池,铅蓄电池是二次电池。
(2)随着温度的升高,纯水的pH增大。
(3)冰醋酸、纯碱、小苏打分别属于酸、碱、盐。
(4)镀锌铁制品破损后,镀层仍能保护铁制品。
(5)醋酸在醋酸钠溶液中电离的程度大于在纯水中电离的程度。
(6)25 ℃时,某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐。
(7)用Na2S去除废水中的Hg2+:Hg2++S2-=HgS↓
(8)pH=2与pH=1的硝酸中c(H+)之比为1:10
(9)Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1
(10)向含有硫酸钙的水垢中加入碳酸钠溶液,沉淀的转化可表示为:
CaSO4(s)  SO42— + Ca2+
SO42— + Ca2+
CO32—  CaCO3(s)
CaCO3(s)
参考答案:(10分)(1)对 (2)错 (3)错 (4)对 (5)错
(6)错 (7)对 (8)对 (9)错 (10)对
本题解析:电离是吸热的,所以升高温度,水的pH是减小的,②不正确;纯碱是碳酸钠,属于盐,而不是碱,③不正确;醋酸钠溶液中CH3COO-的浓度大,抑制醋酸的电离,⑤不正确;⑥不正确,也可能是酸式盐,例如硫酸氢钠等;碳酸钠溶于水,CO32—水解,所以Na2CO3溶液中c(Na+)与c(CO32-)之比大于2
本题难度:一般
2、选择题 向纯水中加入少量KHSO4(s),温度不变,则下列叙述正确的是( )
A.c(OH-)增大
B.c(H+)减小
C.c(OH-)与c(H+)之积增大
D.抑制了水的电离
参考答案:D
本题解析:
本题难度:简单
3、填空题 (6分)已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20mL0.01mol/LCH3COOH溶液中逐滴加入0.01mol/L KOH溶液,其pH变化曲线如下图所示(忽略温度变化)。请回答下列有关问题:
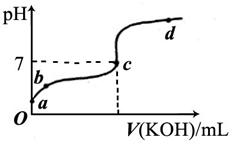
(1)a点溶液中c(H+)为 。
(2)b点溶液中离子浓度的大小顺序可能有 种情况。
(3)a、b、c三点中水的电离程度最大的是 。
参考答案:(1)4×l0-4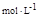 (2)3 (3)c
(2)3 (3)c
本题解析:(1)K=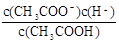 ,溶液中的c(CH3COO-)=c(H+),所以c(H+)=
,溶液中的c(CH3COO-)=c(H+),所以c(H+)=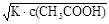 =4×l0-4
=4×l0-4 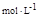 。
。
(2)b点溶液呈酸性,则可能是c(CH3COO-)>c(H+)>c(K+)>c(OH-)或c(CH3COO-)>c(K+))>c(H+)>c(OH-)或c(CH3COO-)>c(H+)=c(K+)>c(OH-)三种情况。
(3)酸或碱抑制水的电离,有弱的盐促进水的电离,所以c点水的电离程度最大。
考点:弱电解质的电离
点评:本题难度较大,由电离平衡常数求c(H+)时,要注意忽略已电离的酸。
本题难度:一般
4、选择题 现有常温下的四份溶液:① 0.01mol/LCH3COOH;② 0.01mol/LHCl;③ pH=12的氨水;④ pH=12的NaOH溶液。下列说法正确的是
A.①中水的电离程度最小,②③④中水的电离程度一样大
B.将②③混合,若pH=7,则消耗溶液的体积:②<③
C.将①、④混合,若有c(CH3COO¯)>c(H+),则混合液一定呈碱性
D.将①、④等体积混合,所得溶液中一定有:c(OH¯)=c(H+) + c(CH3COOH)
 ,c(Fe3+)降低,水解平衡左移,pH值增大,故C正确;加入适量蒸馏水,c(Fe3+)、c(H+)都减小,故D正确。
,c(Fe3+)降低,水解平衡左移,pH值增大,故C正确;加入适量蒸馏水,c(Fe3+)、c(H+)都减小,故D正确。