微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 A、B是元素周期表中同周期相邻主族的元素,A、B的原子序数依次为a、b且a<b,则a、b之间不可能存在的等式关系是( )
A.b=a+1
B.b=a+11
C.b=a+18
D.b=a+25
参考答案:C
本题解析:
本题难度:一般
2、填空题 短周期主族元素A、B、C、D的原子序数依次增大,A与D同主族,B与C在同一周期,B原子最外层电子数比C原子少2个,A、C单质在常温下均为气体,它们在一定条件下以体积比2:1完全反应,生成物在常温下是液体.此液体与D单质在常温下能剧烈反应生成A的单质.所得溶液滴入酚酞显红色.回答下列问题:
(1)写出元素符号A______,B______,C______,D______.
(2)写出B与C两种单质完全反应后所得生成物的电子式______,该分子空间构型为______.
(3)C、D两种单质在点燃条件下形成的化合物的电子式
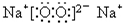
,判断其中的化学键的类型______.
(4)写出两种由A、B、C、D四种元素组成的化合物的化学式______、______.
参考答案:根据A、C单质在常温下均为气体,它们在一定条件下以体积比2:1完全反应,生成物在常温下是液体.可知液体是水,A为氢气,C为氧气;根据水与D单质在常温下能剧烈反应生成A的单质,所得溶液滴入酚酞显红色,且A与D同主族,短周期主族元素,可知D为钠;根据B与C在同一周期,B原子最外层电子数比C原子少2个,可知B为碳,
(1)因A为氢气,B为碳,C为氧气,D为钠,四种元素的元素符号分别是:H、C、O、Na、故答案为:H;C;O;Na.
(2)因碳与氧气完全反应后生成二氧化碳,故答案为:

; 直线形;
(3)因过氧化钠中既有钠离子和过氧根离子之间的离子键又有氧原子和氧原子之间的共价键,故答案为:离子键,非极性键;
(4)Na、H、C、O四中元素四种元素组成的化合物有NaHCO3、CH3COONa,故答案为:NaHCO3;CH3COONa.
本题解析:
本题难度:一般
3、填空题 现有几种元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构
T
失去一个电子后,形成Ne原子电子层结构
X
最外层电子数是次外层电子数的2倍
Y
其单质之一是空气中主要成分,最常见的助燃剂
Z
形成双原子单质分子,黄绿色气体
|
(1)元素X的一种同位素用来作原子量标准,这种同位素的符号是______.
(2)画出T的原子结构示意图______.
(3)写出工业上制取单质Z的化学方程式______.
(4)写出由T、Y和Z三种元素组成的一种化合物在水溶液中的电离方程式______.
参考答案:T失去一个电子后,形成Ne原子电子层结构,则T是Na元素;
X最外层电子数是次外层电子数的2倍,则其次外层是第一电子层,所以X是C元素;
Y其单质之一是空气中主要成分,最常见的助燃剂,则Y是O元素;
Z形成双原子单质分子,黄绿色气体,则Z是Cl元素.
(1)元素X的一种同位素C-12用来作原子量标准,这种同位素的符号是612C,故答案为:612C;
(2)钠原子核外有11个电子,则钠的原子结构示意图为
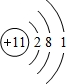
,故答案为:
;
(3)工业上用电解饱和氯化钠溶液的方法制取氯气,所以工业上制取氯气的化学方程式为
2NaCl+2H2O?电解?.?Cl2↑+H2↑+2NaOH,故答案为:2NaCl+2H2O?电解?.?Cl2↑+H2↑+2NaOH;
(4)由T、Y和Z三种元素组成的一种化合物为NaClO,次氯酸钠是强电解质,所以其在水溶液中的电离方程式为:
NaClO=Na++ClO-,故答案为:NaClO=Na++ClO-.
本题解析:
本题难度:一般
4、简答题 B、C、D、E均是短周期元素,原子序数依次增大,B元素原子最外层上的电子数为内层电子总数的2倍.B元素原子和C元素原子最外层电子数之差为2.C和D形成的化合物进行焰色反应火焰呈黄色.E元素的气态单质、E的最高价氧化物的水化物均能与D的最高价氧化物的水化物反应.
(1)上述4种元素按照原子序数由大到小排列为______、______、______、______;(填元素符号);
(2)B、C形成的化合物(比空气重)的结构式为______;
(3)C、D的单质在加热条件下生成物质X,其中含有化学键的类型为______;X的电子式为______;
(4)E的离子结构示意图为______;
(5)Y是C的气态氢化物.常温下,将D的单质投入Y中,发生反应的离子方程式为______;该反应______(填“能”、“不能”)作为设计原电池的反应原理.
参考答案:B、C、D、E均是短周期元素,B元素原子最外层上的电子数为内层电子总数的2倍,原子只能有2个电子层,最外层电子数为4,则B为碳元素;B元素原子和C元素原子最外层电子数之差为2,则C元素原子最外层电子数为6或2,C和D形成的化合物进行焰色反应火焰呈黄色,含有钠元素,则D为Na元素,C不能是金属元素,C的原子序数小于Na,故C为氧元素;E元素的气态单质、E的最高价氧化物的水化物均能与D的最高价氧化物的水化物NaOH反应,则E为Cl元素,
(1)上述4种元素按照原子序数由大到小排列为:Cl、Na、O、C,
故答案为:Cl;Na;O;C;
(2)C、O形成的化合物(比空气重)为CO2,分子中C原子与O原子之间形成2对共用电子对,其结构式为 O=C=O,故答案为:O=C=O;
(3)O、Na的单质在加热条件下生成物质X为Na2O2,含有离子键、共价键,其电子式为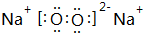 ,
,
故答案为:离子键、共价键; ;
;
(4)E为Cl元素,其离子结构示意图为 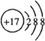 ,故答案为:
,故答案为: ;
;
(5)常温下,将Na的单质投入水中,发生反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,该反应属于氧化还原反应,能作为设计原电池的反应原理,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;能.
本题解析:
本题难度:一般
5、填空题 A、B、C、D都是短周期元素,原子半径D>C>A>B.已知:A、B位于同一周期;A、C位于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外电子层上的电子数是D原子最外电子层上的电子数的4倍.试回答:
(1)这四种元素名称分别是:
A______,C______,D______.
(2)写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式______.
(3)B、C形成化合物属______晶体.
(4)B、D形成的化合物与A、B形成的化合物反应放出B单质,反应方程式为______.
参考答案:根据原子半径D>C>A>B,且A、B同周期,A、C同主族,推知A、B、C、D在周期表中的大致相对位置为:
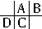
,C的原子核内的质子数等于A、B原子核内的质子数之和,C等于A+8,故B为8号元素氧.因A、C为主族元素,且C最外层电子数为A的4倍,故D为钠元素,C为硅元素,A为碳元素.
(1)由上述分析可知,A为碳元素,C为硅元素,D为钠元素.
故答案为:碳;硅;钠.
(2)A为碳元素,B为氧元素,D为钠元素,A、B、D组成的化合物为Na2CO3,B、C组成的化合物为SiO2,碳酸钠与二氧化硅反应方程式为Na2CO3+SiO2?高温?.?Na2 SiO3+CO2.
故答案为:Na2CO3+SiO2?高温?.?Na2 SiO3+CO2.
(3)B为氧元素,C为硅元素,B、C组成的化合物为SiO2,SiO2属于原子晶体.
故答案为:原子晶体.
(4)A为碳元素,B为氧元素,D为钠元素,B、D形成的化合物与A、B形成的化合物反应放出B单质,则B、D形成的化合物为Na2O2,A、B形成的化合物为CO2,过氧化钠与二氧化碳反应为2Na2O2+2CO2=2Na2CO3+O2.
故答案为:2Na2O2+2CO2=2Na2CO3+O2.
本题解析:
本题难度:一般