微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害。
Ⅰ.氨气是一种重要的化工原料。
(1)NH3与CO2在120oC,催化剂作用下反应生成尿素:CO2(g) +2NH3(g) (NH2)2CO(s) +H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:
(NH2)2CO(s) +H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:

则A点的逆反应速率V(逆)(CO2) B点的正反应速率V(正)(CO2)(填“>”“=”或“<”),氨气的平衡转化率是 。
(2)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s) 2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为 。该反应的化学平衡常数的表达式为________。
2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为 。该反应的化学平衡常数的表达式为________。
Ⅱ.氮的氧化物会污染环境。
(3)采取还原法,用炭粉可将氮的氧化物还原。
已知:N2(g)+O2(g)=2NO(g) △H=" +180.6" kJ·mol-1
C(s)+O2(g)=CO2(g) △H= —393.5 kJ·mol-1
写出炭粉还原一氧化氮的热化学反应方程式 。
(4)若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则此反应的离子反应方程式为________。若生成的CO2完全逸出,所得溶液中的离子浓度大小关系为________。
参考答案:(14分,每空2分) (1)< (1分)0.75 (2) 26 K=c2(NH3)×c(CO2)
(3)C(s)+2NO(g)=CO2(g)+N2(g) △H= -574.1kJ·mol-1
(4)2NO2 + CO32- = CO2 + NO2— +NO3— ; C (Na+)>C (NO3—)> C (NO2—)> C (OH—)> C (H+)
本题解析:(1)根据图像可知A点氨气的含量是变化的,这说明A点没有达到平衡状态,而B点达到平衡状态。A点到B点的氨气含量降低,这说明A点反应向正反应方向进行,正反应速率大于逆反应速率,则A点的逆反应速率V(逆)(CO2)小于B点的正反应速率V(正)(CO2)。根据图像可知起始时氨气和CO2的体积相等,设物质的量均是1mol,消耗氨气的物质的量是xmol,则生成水蒸气的物质的量是0.5xmol。平衡时氨气的含量是0.2,则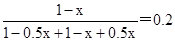 ,解得x=0.75,所以氨气的平衡转化率是0.75、
,解得x=0.75,所以氨气的平衡转化率是0.75、
(2)根据方程式可知生成的氨气和CO2的体积之比是2:1,则混合气体的平均相对分子质量是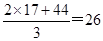 。由于只有生成物中有气体,则二者的体积之比是2:1,所以该反应的化学平衡常数的表达式为K=c2(NH3)×c(CO2)。
。由于只有生成物中有气体,则二者的体积之比是2:1,所以该反应的化学平衡常数的表达式为K=c2(NH3)×c(CO2)。
(3)已知:① N2(g)+O2(g)=2NO(g) △H=" +180.6" kJ·mol-1,② C(s)+O2(g)=CO2(g) △H= —393.5 kJ·mol-1,则根据盖斯定律可知①—②即可得到炭粉还原一氧化氮的热化学反应方程式为C(s)+2NO(g)=CO2(g)+N2(g) △H= -574.1kJ·mol-1。
(4)9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,NO2的物质的量是0.2mol,这说明氮元素的化合价部分升高到+5价,另外一半降低到+3价,则此反应的离子反应方程式为2NO2 + CO32- = CO2 + NO2— +NO3— ;若生成的CO2完全逸出,由于亚硝酸根水解,溶液显碱性,则所得溶液中的离子浓度大小关系为C (Na+)>C (NO3—)> C (NO2—)> C (OH—)> C (H+)。
考点:考查平衡状态计算、平衡常数、盖斯定律应用以及氧化还原反应计算和离子浓度大小比较等
本题难度:困难
2、选择题 以下是碘与氢气反应的热化学方程式,有关判断正确的是
(
参考答案:
本题解析:
本题难度:一般
3、填空题 能源危机当前是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是 (填字母)。
a. 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b. 大力开采煤、石油和天然气以满足人们日益增长的能源需求
c. 开发太阳能、水能、风能、地热能等新能源、减少使用煤、石油等化石燃料
d. 减少资源消耗,增加资源的重复使用、资源的循环再生
参考答案:
本题解析:
本题难度:一般
4、填空题 氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱的原料,也是一种常用的制冷剂。
(1) 实验室制备氨气的化学反应方程式为_________。
(2) 工业合成氨的反应方程式为:N2(g)+3H2(g) 2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成
2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成
参考答案:
本题解析:
本题难度:困难
5、选择题 已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是
[? ]
A.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l);△H = -4b KJ/mol
B.C2H2(g) + 5/2O2(g) == 2CO2(g) + H2O(l);△H = 2b KJ/mol
C.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l);△H = -2b KJ/mol
D.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l);△H = b KJ/mol
参考答案:A
本题解析:
本题难度:简单