|
|
|
高中化学知识点大全《电解池原理》考点特训(2017年冲刺版)(二)
2017-08-22 15:36:11
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):
①A+B 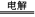 M+D+E;②E+M=A+F+B M+D+E;②E+M=A+F+B

请回答:
(1)若A是一种钠盐,该反应是化学工业上制单质E和化合物M的重要方法。该化学工业称为 (填字母编号:a.硫酸工 业 b.氯碱工业 c.合成氨工业d.侯氏制碱工业),写出上述反应②的离子方程式为__________ 。
(2)若A是一种含氧酸盐,该反应中电极上会析出红色固体。则其电解反应方程式是: 。上述两种不同反应中的产物E((1)题)和产物F((2)题)有一种共同的用途是__ ____, 二者反应的离子方程式为______________ __。
参考答案:(共9分,第1空1分,其余各2分)(1)氯碱工业, Cl2+2OH-=Cl-+ClO-+H2O
(2)2CuSO4+2H2O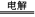 2Cu+O2↑+H2SO4 漂白 Cl2+SO2+2H2O=4H++2Cl-+SO42- 2Cu+O2↑+H2SO4 漂白 Cl2+SO2+2H2O=4H++2Cl-+SO42-
本题解析:(1)若A是一种钠盐,该反应是化学工业上制单质E和化合物M的重要方法,则该化学工业称为氯碱工业,所以A是氯化钠,B是水,M是氢氧化钠。则根据反应②可知,E是氯气,所以D是氢气,F是次氯酸钠,因此反应②的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
(2)若A是一种含氧酸盐,该反应中电极上会析出红色固体,则A应该是硫酸铜,B是水,E是铜,M是硫酸,F是二氧化硫,D是氧气,所以电解反应方程式是2CuSO4+2H2O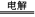 2Cu+O2↑+H2SO4。氯气和二氧化硫都具有漂泊性。又因为氯气具有氧化性,二氧化硫具有还原性,所以二者混合反应的离子方程式是Cl2+SO2+2H2O=4H++2Cl-+SO42-。 2Cu+O2↑+H2SO4。氯气和二氧化硫都具有漂泊性。又因为氯气具有氧化性,二氧化硫具有还原性,所以二者混合反应的离子方程式是Cl2+SO2+2H2O=4H++2Cl-+SO42-。
考点:考查电解产物的有关判断、方程式的书写
点评:该题是中等难度的试题,试题注重基础,侧重考查学生对电解原理应用的了解掌握程度,以及灵活运用基础知识解决实际问题的能力。该题学生需要明确的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
2、选择题 下列叙述正确的是
A.工业上电解熔融的Al2O3冶炼铝用铁做阳极
B.用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成2 molNaOH
D.用惰性电极电解CuSO4溶液一段时间后,加入CuO固体可以使CuSO4溶液恢复原来浓度
|
参考答案:D
本题解析:A.工业上电解熔融的Al2O3冶炼铝用石墨做阳极,错误;B.用惰性电极电解Na2SO4溶液,由于溶液中阴离子的放电能力OH->SO42-,所以在阳极发生反应:4OH—-4e-=O2↑+2H2O,阳离子的放电能力:H+>Na+,所以在阴极发生反应:2H++2e-=H2↑,实质就是电解水,电解的总方程式是2H2O 2H2↑+ O2↑。由于在整个闭合回路中电子转移数目相等,所以阴、阳两极产物的物质的量之比为2:1,错误;C.用惰性电极电解饱和NaCl溶液,电解的方程式是:2NaCl+2H2O 2H2↑+ O2↑。由于在整个闭合回路中电子转移数目相等,所以阴、阳两极产物的物质的量之比为2:1,错误;C.用惰性电极电解饱和NaCl溶液,电解的方程式是:2NaCl+2H2O H2↑+ Cl2↑+2NaOH。若有1 mol电子转移,则生成1 molNaOH,错误;D.用惰性电极电解CuSO4溶液,方程式是:2CuSO4+2H2O H2↑+ Cl2↑+2NaOH。若有1 mol电子转移,则生成1 molNaOH,错误;D.用惰性电极电解CuSO4溶液,方程式是:2CuSO4+2H2O 2Cu+O2↑+2H2SO4.电解一段时间后,由于两个电极的反应产物是Cu、O2,二者发生反应产生的是CuO,加入CuO固体可以与反应产生的硫酸反应变为CuSO4,使CuSO4溶液恢复原来浓度,正确。 2Cu+O2↑+2H2SO4.电解一段时间后,由于两个电极的反应产物是Cu、O2,二者发生反应产生的是CuO,加入CuO固体可以与反应产生的硫酸反应变为CuSO4,使CuSO4溶液恢复原来浓度,正确。
考点:考查电解反应原理的应用的知识。
本题难度:一般
3、简答题 用石墨棒做电极、用直流电电解500mL饱和食盐水,电解一段时间后,在一个电极上产生7.1g氯气.求:
(1)这段时间内在另一电极上产生的氢气的体积是多少(标准状况下)?
(2)溶液中NaOH的物质的量浓度是多少(氯气跟NaOH的反应、以及溶液体积的变化均忽略不计)?
参考答案:(1)用石墨棒做电极、用直流电电解500mL饱和食盐水,电解一段时间后,反应的化学方程式为:2NaCl+2H2O?通电?.?2NaOH+H2↑+Cl2↑,阳极上生成氯气7.1g物质的量为0.1mol,所以根据化学方程式计算得到生成氢气物质的量为0.1mol,标准状况气体体积=0.1mol×22.4L/mol=2.24L,
答:产生的氢气的体积是2.24?L;?
(2)氯气跟NaOH的反应、以及溶液体积的变化均忽略不计,依据化学方程式计算可知生成氢氧化钠物质的量为0.2mol,氢氧化钠溶液的浓度为0.2mol0.5L=0.4mol/L,
答:溶液中NaOH的物质的量浓度是0.40?mol?L-1.
本题解析:
本题难度:一般
4、选择题 (2014届浙江省宁波市十校高三3月联考理综化学试卷)
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
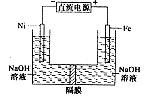
A.铁是阳极,电极反应为Fe-6e一+4H2O=FeO42-+ 8H+
B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
参考答案:D
本题解析:
A项中,铁是阳极,但溶液是碱性,不可能生成8H+,不正确;B项中,电解时电子的流动方向为:负极→Ni电极,溶液中是离子导电,再是Fe电极→正极,故不正确;C项中,因阳极消耗OH-,故OH-通过阴离子交换膜自左向右移动,C不正确; D项中,电解时阳极吸引OH-而使附近的pH降低、阴极区因OH-向右侧移动而pH升高;因为总反应消耗OH-,撤去隔膜混合后,与原溶液比较pH降低,说法正确。
本题难度:一般
5、填空题 (10)(1)氯碱工业是利用电解食盐水生产?①?为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、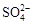 等杂质离子,下列加入顺序合理的是?②。 等杂质离子,下列加入顺序合理的是?②。
A.碳酸钠、氢氧化钠、氯化钡
B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡
D.氯化钡、氢氧化钠、碳酸钠
|
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
成分
| NaCl
| Mg(OH)2
| CaCO3
| BaSO4
| 其他不溶于酸的物质
|
质量分数(%)
| 15~20
| 15~20
| 5~10
| 30~40
| 10~15
|
为生产七水硫酸镁,设计了以下工艺流程:
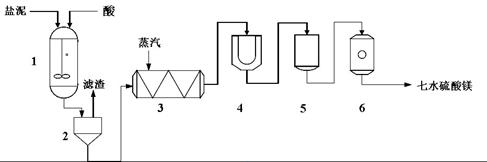
生产七水硫酸镁工艺流程图
1-反应器? 2-过滤器? 3-蒸发浓缩器? 4-结晶槽? 5-洗涤槽? 6-真空干燥器
装置1中加入的酸应选用
?③?,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是
?④?。
装置2中滤渣的主要成分为
?⑤?。
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是__⑥__。
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是
?⑦?。
参考答案:(1)①氯气、烧碱、氢气(只写出氯气和烧碱也可)。(2分)?(2)②D。
(3)③(稀)硫酸。?④搅拌过程中CO2不断逸出,使平衡CaCO3+H2SO4 CaSO4+H2CO3(H2O+CO2↑)不断向右移动。(2分)
CaSO4+H2CO3(H2O+CO2↑)不断向右移动。(2分)
⑤CaSO4、BaSO4、其它不溶物质。(2分)?⑥氯化钠。?⑦防止失去结晶水。
本题解析:(1)氯碱工业是利用电解食盐水生产氯气、烧碱、氢气为基础的工业体系。
(2)考查物质的分离和提纯。Ca2+用碳酸钠除去,Mg2+用氢氧化钡除去,SO42-用氯化钡除去,最后加入盐酸酸化。但用于过量的钡离子要用碳酸钠来除,所以碳酸钠必需放在氯化钡和氢氧化钡的后面,因此正确的答案选D。
(3)应用是生成七水硫酸镁,所以应该加入的是稀硫酸;应用在搅拌过程中CO2不断逸出,使平衡CaCO3+H2SO4 CaSO4+H2CO3(H2O+CO2↑)不断向右移动,所以碳酸钙可以转化为硫酸钙;根据“盐泥”的组成可知,装置2中的不溶物一定含有硫酸钡,同时还含有生成的硫酸钙等其它不溶物质;应用滤液中还含有氯化钠,所以通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,析出的晶体主要是氯化钠;应用在空气中加热硫酸镁晶体易失去结晶水,所以在真空中加热的目的就是防止失去结晶水。
CaSO4+H2CO3(H2O+CO2↑)不断向右移动,所以碳酸钙可以转化为硫酸钙;根据“盐泥”的组成可知,装置2中的不溶物一定含有硫酸钡,同时还含有生成的硫酸钙等其它不溶物质;应用滤液中还含有氯化钠,所以通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,析出的晶体主要是氯化钠;应用在空气中加热硫酸镁晶体易失去结晶水,所以在真空中加热的目的就是防止失去结晶水。
本题难度:一般

 CaSO4+H2CO3(H2O+CO2↑)不断向右移动。(2分)
CaSO4+H2CO3(H2O+CO2↑)不断向右移动。(2分) CaSO4+H2CO3(H2O+CO2↑)不断向右移动,所以碳酸钙可以转化为硫酸钙;根据“盐泥”的组成可知,装置2中的不溶物一定含有硫酸钡,同时还含有生成的硫酸钙等其它不溶物质;应用滤液中还含有氯化钠,所以通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,析出的晶体主要是氯化钠;应用在空气中加热硫酸镁晶体易失去结晶水,所以在真空中加热的目的就是防止失去结晶水。
CaSO4+H2CO3(H2O+CO2↑)不断向右移动,所以碳酸钙可以转化为硫酸钙;根据“盐泥”的组成可知,装置2中的不溶物一定含有硫酸钡,同时还含有生成的硫酸钙等其它不溶物质;应用滤液中还含有氯化钠,所以通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,析出的晶体主要是氯化钠;应用在空气中加热硫酸镁晶体易失去结晶水,所以在真空中加热的目的就是防止失去结晶水。