微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)下表是周期表中的一部分,根据a—n在周期表中的位置,按要求回答问题:
?
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
1
| a
| ?
| ?
|
2
| ?
| ?
| ?
| b
| c
| ?
| d
| e
|
3
| f
| g
| h
| i
| j
| k
| m
| n
|
(1)表中元素,只有负价而无正价的元素是?,氧化性最强的单质是?。(本小题均填物质的名称)
(2)最高价氧化物的水化物中碱性最强的是?,呈两性的是?,写出它与氢氧化钠反应的离子方程式? 。(本小题均用化学式表示)
(3)在b、c、d、f、g、h中,原子半径从大到小的顺序为的是?。(用元素符号表示)。
(4) 比较k、m的气态氢化物的稳定性?。(用化学式表示)
参考答案:(1)氟、氟气(2)Na、AL、 AL(OH)3 + OH-=Al3+?+ 2H2O(3)Na>Mg>Al>C>N? (4)H2S<HCl
AL(OH)3 + OH-=Al3+?+ 2H2O(3)Na>Mg>Al>C>N? (4)H2S<HCl
本题解析:(1)表中元素,只有负价而无正价的元素为非金属性最强的元素即为F(氟),氧化性最强的单质即为得电子能力最强的为氟气;
(2)最高价氧化物的水化物中碱性最强的即为元素金属性最强的元素Na,呈两性的是AL,与氢氧化钠溶液反应的离子方程式为:AL(OH)3 + OH-=Al3+?+ 2H2O;
(3)在b、c、d、f、g、h中,原子半径从大到小的顺序为的是:Na>Mg>Al>C>N;
(4)k、m的气态氢化物的稳定性为:H2S<HCl;
本题难度:一般
2、选择题 有A、B、C、D、E五种短周期的主族元素,其原子序数依次增大.其中只有C是金属,D的单质是黄色固体,A、B、D在周期表中的相对位置关系如题6图.下列说法正确的是
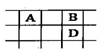
A.E元素位于周期表中的第三周期、ⅥA族
B.B的简单阴离子比D的简单阴离子还原性强
C.B与C形成的化合物中一定含有共价键
D.A、B两元素形成的常见化合物的分子构型均为直线型
参考答案:D
本题解析:根据题意知,A、B、C、D、E五种短周期的主族元素,D的单质是黄色固体,则D为硫元素;根据元素周期表的结构和A、B、D在周期表中的相对位置关系判断,A为碳元素,B为氧元素;又A、B、C、D、E原子序数依次增大,则E为氯元素;C是金属,则C可能为Na、Mg、Al中的一种。A、E为氯元素,位于周期表中的第三周期、ⅦA族,错误;B、非金属性O>S,元素的非金属性越强,对应的简单阴离子的还原性越弱,错误;C、B氧元素,C可能为Na、Mg、Al,B与C形成的化合物中一定含有离子键,错误;D、C、O两元素形成的常见化合物分别为CO、CO2,都为直线形分子,正确。
本题难度:一般
3、选择题 如图所示是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元系符号。已知X
位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢化物XH3有剧毒。下列推测不正确的是(?)
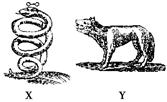
A.原子半径X<Y
B.最高价氧化物对应的水化物酸性X>Y
C.X的氢化物具有强还原性
D.Y与碘同周期,Y的最高价氧化物对应的水化物的酸性比高碘酸(HIO4)强
参考答案:D
本题解析:X的氢化物为XH3,说明X处于V A族,XH3有剧毒。说明不是NH3,其具有强还原性,C正确。Y比X多1个电子层,则原子半径Y>X。X的非金属性强于Y,B正确。Y与碘同周期,则Y的非金属性比碘的弱,则Y的最高价氧化物对应的水化物的酸性比HIO4的弱。
本题难度:一般
4、填空题 (14分)短周期元素A、B、C、D、E在元素周期表中的 位置如下图所示,其中B元素形成的化合物在自然界中的种类最多。
位置如下图所示,其中B元素形成的化合物在自然界中的种类最多。
请回答下列问题
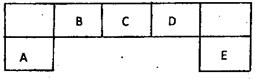

(1)描述D在元素周期表中的位置:?
(2)比较A、C、D元素简单离子半径的大小:____>?>?(填微粒符号)
(3)F与D同主族且相邻,请说出D的氢化物比F的氢化物稳定的根本原因:
?
(4)C的氢化物与其最高价氧化物对应的水化物反应,产物溶于水呈?性,用离子方程式解释原因?。
(5)D原子与氢原子可形成10电子阳离子,写出该阳离子的电子式?
(6)E的最高价氧化物的水化物的化学式为?。E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,该反应的化学反应方程式为
?
参考答案:
本题解析:略
本题难度:一般
5、填空题 (8分)填写下列表格
微粒符号
| 核电荷数
| 中子数
| 核外电子数
| 质量数
|
?
| 11
| 12
| 11
| ?
|
?
| ?
| 16
| 18
| 32
参考答案:(8分)
微粒符号
核电荷数
中子数
核外电子数
质量数
核素符号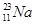
11
12
11
23
核素符号 ? ?
16
16
18
32
本题解析:核电荷数等于原子序数,所以核电荷数为11的元素是钠元素。又因为质子数和中子数之和是质量数,所以其元素符号是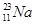 ;根据质量数和中子数可知,该元素的质子数是32-16=16,即是S元素。又因为核外电子数是18,所以是硫离子,即符号是 ;根据质量数和中子数可知,该元素的质子数是32-16=16,即是S元素。又因为核外电子数是18,所以是硫离子,即符号是 。 。
点评:在进行原子组成的有关计算时,需要注意几个守恒关系,分别是中子数+质子数=质量数、质子数=核外电子数=核电荷数=原子序数。另外在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,据此可以判断。
本题难度:一般
|