微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 配制物质的量浓度的溶液,造成浓度偏高的操作是( )
A.定容时,滴加蒸馏水超过刻度线
B.定容时,眼睛俯视刻度线
C.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
D.定容时,眼睛仰视刻度线
参考答案:A、定容时,滴加蒸馏水超过刻度线,溶液的体积偏大,浓度偏小,故A错误;
B、定容时,眼睛俯视刻度线,溶液的液面未达到刻度线,溶液的体积偏小,浓度偏大,故B正确;
C、洗涤烧杯和玻璃棒的溶液未转入容量瓶中,洗涤液中含有杂质,溶质的质量偏小,浓度偏小,故C错误;
D、定容时,眼睛仰视刻度线,溶液的液面超过刻度线,溶液的体积偏大,浓度偏小,故D正确;
故选:B.
本题解析:
本题难度:一般
2、选择题 配制一定物质的量浓度的溶液时,下列操作会使所配溶液浓度偏高的是( )
A.省去洗涤烧杯的步骤
B.定容时俯视
C.定容时仰视
D.容量瓶水洗未干燥
参考答案:B
本题解析:
本题难度:简单
3、选择题 用于配制一定物质的量浓度的溶液的实验装置是( )
A.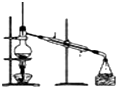
B.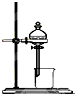
C.
D.
参考答案:A、这个装置是实验室蒸馏装置,不是配制一定物质的量浓度溶液的装置,故A错误;
B、此装置是萃取装置,不是配制一定物质的量浓度的溶液装置,故B错误;
C、该装置是过滤装置,不是配制一定物质的量浓度的溶液的装置,故C错误;
D、该装置是配制一定物质的量浓度的溶液的装置,故D正确;
故选D.
本题解析:
本题难度:一般
4、简答题 用18mol/L的浓硫酸配制80mL?1.0mol/L的稀硫酸,需用的实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号)______.
(2)在容量瓶的使用方法中,下列操作不正确的是______?(填写标号).
A.使用容量瓶前先检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2cm处,用滴管滴加蒸馏水到标线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
(3)用量筒取浓硫酸______
(4)在G.50mL烧杯中的操作是如何进行的?______
(5)溶解、冷却,该步实验中需要使用玻璃棒,目的是______.
(6)转移、洗涤.在转移时应使用______引流,需要洗涤烧杯2~3次是为了______.
(7)定容,摇匀.
(8)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签(注明配制的时间、溶液名称及浓度.)
(9)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会______(填“偏高”、“偏低”或“无影响”).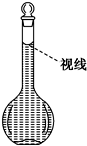
参考答案:(1)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作.
没有80mL容量瓶,需要选择100mL容量瓶,配制溶液体积为100mL,设需要浓硫酸的体积为V,根据稀释定律有:1.0mol/L×0.1L=18mol/L×V,解得V=0.0056L=5.6mL,故需要选择10mL量筒.
用10mL量筒量取浓硫酸,在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至凹液面与刻度线水平相切,盖好瓶塞摇匀,故选用仪器的先后顺序是:EGCHF,
故答案为:EGCHF;
(2)A、因配制后要摇匀,容量瓶在使用前要检查是否漏水,故A正确;
B、容量瓶用蒸馏水洗净后,不能用待配溶液润洗,会导致溶液浓度偏大,故B错误;
C、容量瓶只能在常温下使用,不能用来溶解固体或稀释溶液,溶解或稀释会产生热效应,冷却后导致所配溶液体积不准确,甚至导致容量瓶破裂,故C错误;
D、容量瓶只能在常温下使用,不能用来溶解固体或稀释溶液,溶解或稀释会产生热效应,冷却后导致所配溶液体积不准确,甚至导致容量瓶破裂,故D错误;
E、盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动几次,目的是使溶液充分混合,浓度均匀,故E正确.
故答案为:BCD;
(3)没有80mL容量瓶,需要选择100mL容量瓶,配制溶液体积为100mL,设需要浓硫酸的体积为V,根据稀释定律有:1.0mol/L×0.1L=18mol/L×V,解得V=0.0056L=5.6mL,
故答案为:5.6;
(4)浓硫酸稀释操作为:先在烧杯中倒入适量的水,然后将浓硫酸沿烧杯壁慢慢倒入水中,并用玻璃棒搅拌;
故答案为:先在烧杯中倒入适量的水,然后将浓硫酸沿烧杯壁慢慢倒入水中,并用玻璃棒搅拌;
(5)溶解、冷却中需要使用玻璃棒进行搅拌,
故答案为:搅拌;
(6)向容量瓶转移溶液需要用玻璃棒引流.烧杯壁沾有少量溶质,洗涤并将洗涤液移入容量瓶,保证溶质全部移入容量瓶中,
故答案为:玻璃棒;保证溶质全部移入容量瓶中;
(9)定容时仰视,溶液液面在刻度线上方,所配溶液的体积偏大,导致所配溶液的浓度偏低,
故答案为:偏低.
本题解析:
本题难度:一般
5、选择题 要配制浓度约为1mol/LNaOH溶液100mL,下列操作错误的是( )
A.在托盘天平上放两片大小、质量一样的纸,然后将氢氧化钠放在纸片上称量
B.把称得的氢氧化钠放入盛有适量蒸馏水的烧杯中,溶解、冷却,再把溶液移入容量瓶
C.用蒸馏水洗涤烧杯、玻璃棒2-3次,洗涤液也移入容量瓶
D.沿玻璃棒往容量瓶中加入蒸馏水,到刻度线1-2cm时改用胶头滴管滴加,直到溶液凹液面恰好与刻度线相切
参考答案:A、称量氢氧化钠固体时应该放在小烧杯中,并且快速称量,不能直接放在托盘天平的托盘称量,否则既腐蚀托盘,又容易造成氢氧化钠潮解、变质,故A错误;
B.氢氧化钠溶于水会放热,故冷却后转移容量瓶,故B正确;
C.烧杯和玻璃棒上有沾的溶质,故要洗涤和转移操作,故C正确;
D.定容时使用胶头滴管,防止加入水过量,读数时平视,故D正确;
故选A.
本题解析:
本题难度:简单