微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 已知ClO4F的熔点为-167℃,沸点为-15.9℃,易分解或接触有机物发生爆炸;又知无水KF易吸收F2、HF和H2O;F2、HF、O2的沸点分别为-188℃、19.54℃、-183℃.李明采用特制的耐氟容器,使氟气缓缓地与一定浓度的HClO4反应来制取ClO4F,其实验装置如图所示,试回答:
(1)实验中生成X的化学方程式是______;
(2)现有10%和30%的HClO4,李明最好选用______,理由是______;
(3)B中冷却剂选用液氧的理由是______;
(4)A中填充环状物的作用是______.
参考答案:(1)该反应中,反应物为HClO4和F2,生成物为ClO4F,根据质量守恒可知,另一种生成物为HF,则反应的化学方程式为HClO4+F2=ClO4F+HF,故答案为:HClO4+F2=ClO4F+HF;
(2)反应物浓度越大,则反应速率越大,则应选用30%的HClO4,
故答案为:30%的HClO4;浓度增大,反应速率加快;
(3)液氧的沸点为-183℃,ClO4F的熔点为-167℃,B中冷却剂选用液氧有利于ClO4F成为固体,便于ClO4F的分离,
故答案为:因为液氧提供的低温可以使ClO4F成为固体,便于ClO4F的分离;
(4)A中填充环状物可增大气体与液体的接触面积,提高反应速率,
故答案为:增大F2与HClO4的接触面积,以提高反应速率,有利于反应朝预定方向进行.
本题解析:
本题难度:一般
2、选择题 向某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+B(g)?2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时问的变化如图所示:
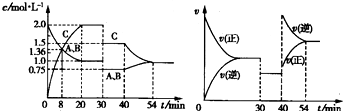
下列说法中正确的是( )
A.30~40?min时间段该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30?min时降低温度,40?min时升高温度
D.8?min前A的平均反应速率为0?08?mol?L-1?min-1?
参考答案:A.由图象可知,30~40?min只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,故A错误;
B.由开始到达到平衡,A、B的浓度减少的量相同,由此可知X=1,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故B错误;
C.由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,故C错误;
B.反应从开始到8min内A浓度减少了0.64mol/L,故A的反应速率为0.64mol/L8min=0.08 mol/(L?min),故D正确;
故选D.
本题解析:
本题难度:简单
3、选择题 100ml 2mol/L的稀硫酸与过量的锌反应,为加快反应速率,又不影响氢气的总量,可采用的方法是( )
A.不用稀硫酸,改用98%浓硫酸
B.加入数滴氯化铜溶液
C.加入适量的蒸馏水
D.加入更多锌片
参考答案:A、浓硫酸和Zn反应生成的不是氢气,虽然反应速率加快,但影响氢气的生成总量,故A错误;
B、加入数滴CuCl2溶液,Zn与氯化铜反应置换出铜,形成原电池,反应速率加快,故B正确;
C、加入蒸馏水可以将酸稀释,酸的浓度越小,反应速率减慢,故C错误;
D、固体Zn量的增减不会改变化学反应速率,故D错误.
故选B.
本题解析:
本题难度:一般
4、选择题 下列实验设计不能达到预期目的是( )
| 选项 | 实验操作 | 实验目的
?A
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液
说明一种沉淀能转化为另一种更难溶的沉淀
?B
在两支试管中分别加入相同体积相同浓度的H2O2溶液,再向其中一支试管中加入适量FeCl3溶液
研究催化剂对反应速率的影响
?C
向沸腾的蒸馏水中逐滴滴入适量FeCl3饱和溶液,边滴边用玻璃棒搅拌,继续煮沸
制备Fe(OH)3胶体
?D
将铜片和锌片用导线连接后同时插入稀硫酸溶液中
比较锌和铜的金属活泼性
|
A.A
B.B
C.C
D.D
参考答案:A.由沉淀转化中溶解度小的向溶解度更小的方向移动,则向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液,可观察到白色沉淀转化为黑色沉淀,说明一种沉淀能转化为另一种更难溶的沉淀,故A正确;
B.氯化铁在过氧化氢分解中作催化剂,则在两支试管中分别加入相同体积相同浓度的H2O2溶液,再向其中一支试管中加入适量FeCl3溶液,观察到加氯化铁的反应快,可说明催化剂对反应速率的影响,故B正确;
C.向沸腾的蒸馏水中逐滴滴入适量FeCl3饱和溶液,可制备胶体,但制备胶体的过程中,不能搅拌或加热,搅拌或加热能发生胶体聚沉,故C错误;
D.原电池中负极金属较活泼,则将铜片和锌片用导线连接后同时插入稀硫酸溶液中,Zn作负极,可比较锌和铜的金属活泼性,故D正确;
故选C.
本题解析:
本题难度:简单
5、简答题 在密闭容器中发生下列反应:I2(g)+H2(g)?2HI(g)(正反应吸热)起始时,n(H2)=amol,n(I2)=bmol.只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”“减小”或“不变”)填入相应的表格.
| 编号 | 反应条件 | 反应速率
(1)
升高温度
(2)
加入催化剂
(3)
再充入amolH2
(4)
将容器容积扩大为原来2倍
参考答案:(1)升高温度,增大活化分子百分数,有效碰撞几率增大,反应速率增大;
(2)加入催化剂,降低反应的活化能,增大活化分子百分数,有效碰撞几率增大,反应速率增大;
(3)再充入a mol H2,反应物浓度增大,反应速率增大;
(4)将容器容积扩大为原来2倍,压强减小,浓度减小,反应速率减小,
故答案为:编号反应条件反应速率(1)升高温度增大(2)加入催化剂增大(3)再充入a mol H2增大(4)将容器容积扩大为原来2倍减小
本题解析:
本题难度:一般
|