微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列的分离方法正确的是( )
A.萃取、分液前不需对分液漏斗检漏
B.用过滤的方法除去NaCl溶液中含有的少量淀粉
C.用酒精萃取碘水中的碘
D.用蒸馏的方法除去水中的不挥发的杂质
参考答案:D
本题解析:
本题难度:简单
2、选择题 为了除去镀在铝表面的铜镀层,可选用的试剂为
A.浓硫酸
B.稀HNO3
C.NaOH溶液
D.浓HNO3
参考答案:D
本题解析:常温下浓HNO3可溶解铜而使Al钝化;浓硫酸在加热时会与铜反应,但加热时与Al也会发生反应。
本题难度:简单
3、填空题 从固体混合物A出发可以发生如下框图所示的一系列变化:
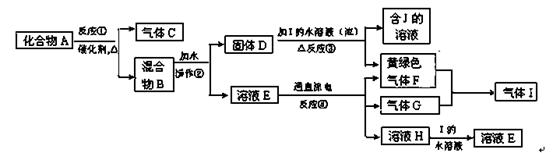
(1)在实验室中常用反应①制取气体C。若要收集气体C,可选择下图装置中的?(填字母)

A? B? C
(2)操作②的名称是?,在操作②中所使用的玻璃仪器的名称是?。
(3)写出下列反应的方程式:
反应①的化学方程式?
反应③的化学方程式?
(4)在实验室中,要获得干燥纯净的黄绿色气体F, 可以将它通过下图中的装置,其中瓶I中盛放的
是?,瓶II中盛放的是? 。
参考答案:(1)A、B;(2)过滤;漏斗、玻璃棒、烧杯;(3)2KClO3 2KCl+3O2↑? MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O ;(4)饱和食盐水,浓H2SO4。
2KCl+3O2↑? MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O ;(4)饱和食盐水,浓H2SO4。
本题解析:F为黄绿色气体,则F为Cl2,反应④为二氧化锰与浓盐酸的反应,则D为MnO2,I为MnCl2,G为不溶于稀硝酸的白色固体;溶液H的焰色反应呈紫色,则G为AgCl,H为KNO3,E为KCl,混合物B为MnO2、KCl的混合物,则反应①为2KClO3 2KCl+3O2↑,A为KClO3、MnO2的混合物,气体C为O2:(1)氧气不溶于水,可选A用排水法收集,氧气的密度比空气的大,可选B用向上排空气法收集;(2)B为MnO2、KCl的混合物,KCl溶于水,而MnO2不溶于水,可利用过滤来分离,过滤操作使用的玻璃仪器为漏斗、玻璃棒、烧杯,为得到固体D,应利用洗涤除去附着在MnO2表面的K+、Cl-等离子,然后再干燥,故答案为:过滤;漏斗、玻璃棒、烧杯;(3)反应①的化学方程式为2KClO3
2KCl+3O2↑,A为KClO3、MnO2的混合物,气体C为O2:(1)氧气不溶于水,可选A用排水法收集,氧气的密度比空气的大,可选B用向上排空气法收集;(2)B为MnO2、KCl的混合物,KCl溶于水,而MnO2不溶于水,可利用过滤来分离,过滤操作使用的玻璃仪器为漏斗、玻璃棒、烧杯,为得到固体D,应利用洗涤除去附着在MnO2表面的K+、Cl-等离子,然后再干燥,故答案为:过滤;漏斗、玻璃棒、烧杯;(3)反应①的化学方程式为2KClO3 2KCl+3O2↑,反应④的离子反应为MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O;(4)要获得干燥纯净的黄绿色气体氯气,瓶Ⅰ中盛放饱和食盐水抑制氯气的溶解同时除去混有的HCl,在瓶Ⅱ中盛放浓H2SO4干燥即可,故答案为:饱和食盐水,浓H2SO4。
2KCl+3O2↑,反应④的离子反应为MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O;(4)要获得干燥纯净的黄绿色气体氯气,瓶Ⅰ中盛放饱和食盐水抑制氯气的溶解同时除去混有的HCl,在瓶Ⅱ中盛放浓H2SO4干燥即可,故答案为:饱和食盐水,浓H2SO4。
本题难度:一般
4、选择题 鉴别某种白色织物是否是蚕丝制品,可选用的适宜方法是(? )
A.滴加盐酸
B.滴加浓硫酸
C.滴加氢氧化钠溶液
D.滴加浓硝酸
参考答案:D
本题解析:蛋白质遇到浓硝酸会发生显色反应,显示黄色,据此可以鉴别某种白色织物是否是蚕丝制品,答案选D。
点评:该题贴近生活,基础性强,有利于调动学生的学习兴趣。该题的关键是熟练记住蛋白质的性质,然后灵活运用即可。
本题难度:简单
5、选择题 电解饱和食盐水,当阴极附近有0.8mol NaOH生成时,导线中通过电子的物质的量是
A.0.16mol
B.0.8 mol
C.0.4mol
D.0.2mol
参考答案:B
本题解析:试题分析:用惰性电极电解饱和NaCl溶液,方程式是2NaCl+2H2O 2NaOH+H2↑+Cl2↑,即生成1mol氢氧化钠,转移1mol电子,所以若阴极附近有0.8molNaOH生成时,导线中通过电子的物质的量是0.8mol,答案选B。
2NaOH+H2↑+Cl2↑,即生成1mol氢氧化钠,转移1mol电子,所以若阴极附近有0.8molNaOH生成时,导线中通过电子的物质的量是0.8mol,答案选B。
考点:考查电解饱和食盐水的有关计算
点评:该题是基础性试题的考查,难度不大。该题的关键是明确电解的原理,然后依据电解方程式灵活运用即可。
本题难度:困难