微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 12.4g?Na2R含Na+0.4mol,则Na2R的摩尔质量为______,R的相对原子质量为______.含R的质量为1.6g的Na2R,其物质的量为______.
参考答案:根据化学式可知Na2R中n(Na+)=2n(Na2R),所以含有0.4molNa+的Na2R的物质的量为0.4mol2=0.2mol,所以Na2R的摩尔质量为12.4g0.2mol=62g/mol;
当摩尔质量以g/mol作单位,数值上等于其相对分子质量,即Na2R的相对分子质量为62,所以R的相对原子质量为62-23×2=16;
1.6gR的物质的量为1.6g16g/mol=0.1mol,根据化学式可知Na2R中n(Na2R)=n(R)=0.1mol.
故答案为:62g/mol;16;0.1mol.
本题解析:
本题难度:一般
2、选择题 科学家刚刚发现了某种元素的原子X,X原子的质量是ag。已知12C(含6个质子和6个中子的一种碳原子,相对原子质量为12)的原子质量是bg,nA是阿伏加德罗常数的值,下列说法正确的是
A.由已知信息可知:nA=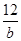
B.X原子的摩尔质量是nAa g/mol
C.Wg X原子的物质的量是 mol
mol
D.X原子的相对原子质量为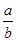
参考答案:AB
本题解析:
A、B正确;C、不正确,Wg X原子的物质的量是 mol ; D.不正确,X原子的相对原子质量为
mol ; D.不正确,X原子的相对原子质量为 。
。
本题难度:一般
3、选择题 标准状况下,一个装满氯气(Cl2)的集气瓶质量为74.6 g,若装满氮气,其质量为66 g,则此容器的体积为(?)
A.22.4 L
B.2.24 L
C.44.8 L
D.4.48 L
参考答案:D
本题解析:用差量法分析,当体积为22.4 L时,装Cl2和装N2的两瓶质量差为43 g,设容器容积为x,则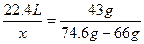 ,所以x="4.48" L。
,所以x="4.48" L。
本题难度:简单
4、选择题 传统的引爆炸药由于其中含Pb,使用时将产生污染,同时其引爆后的剩余炸药还严重危害接触者的人身安全,美国UNC化学教授Thomas?J.Meyer等研发了环境友好、安全型的“绿色”引爆炸药,其中一种可表示为Na2R,它保存在水中可以失去活性,爆炸后不会产生危害性残留物.已知10mL?Na2R溶液含Na+的微粒数为N个,该Na2R溶液的物质的量浓度为( )
A.N×10-2?mol/L
B.
mol/L
C.mol/L
D.mol/L
参考答案:N个Na+的物质的量为N6.02×1023mol-1=N6.02×1023mol,
所以n(Na2R)=12n(Na+)=12×N6.02×1023mol=N1.204×1024mol,
该Na2R溶液的物质的量浓度为N1.204×1024mol0.01L=N1.204×1022mol/L,
故选B.
本题解析:
本题难度:一般
5、填空题 (1) 3.01×1024个OH-的物质的量为 ___ ,质量为 _______ ,这些OH-与标准状况下 L NH3的物质的量相等,如果这些OH-自2L的Ba(OH)2溶液,则该Ba(OH)2的物质的量浓度为 。
(2)同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的质量之比为_________ ____,所含电子数之比为____________,相同质量的氨气和硫化氢气体的分子数之比为__________密度之比为______________,。
参考答案:(每空1分)
(1) 5mol 85g 112 1.25mol/L (2)1:2 , 5:9 , 2:1 ,1:2
本题解析:(1)3.01×1024个OH-的物质的量为:n(OH?)= 3.01×1024÷6.02×1023mol-1=5mol;质量为m(OH?)=5mol×17g/mol=85g;V(NH3)=5mol×22.4L/mol=112L;n[Ba(OH)2]=1/2n(OH?)=1/2×5mol=2.5mol,则c【Ba(OH)2】=2.5mol÷2L=1.25mol?L?1。
(2)同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的物质的量相等,则质量之比等于摩尔质量之比为17:34=1:2;NH3分子含有10个电子,H2S分子含有18个电子,则所含电子数之比为10:18=5:9;相同质量的氨气和硫化氢气体的分子数之比等于物质的量之比,1/17:1/34=2:1;密度之比等于摩尔质量之比17:34=1:2。
考点:本题考查物质的量的相关计算、阿伏加德罗定律及其推论。
本题难度:一般