微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的有
①标准状况下,20g重水(D2O)中含有的电子数为10NA
②0.5 mol Fe2+与足量的H2O2溶液反应,转移NA个电子
③将2mol NO和1molO2混合后,体系中的分子总数为3NA
④常温下,0.4mol SiO2所含的共价健数目为1.6NA
⑤2mol·L-1碳酸钠溶液中Na+的数目是2NA
⑥1mol氯气溶解在水中得到的新制氯水中氢离子的数目是NA
⑦22.4L的N2的共用电子对数为3 NA
A.2个
B.3个
C.4个
D.5个
参考答案:A
本题解析:①D即为 ,质子数、中子数、电子数均为1。1molD2O电子数为10mol,重水的摩尔质量为20g/mol,20g重水物质的量为1mol,①正确;2Fe2++H2O2+2H+=2Fe3++2H2O,1molFe2+失电子数为1mol,②错误;2mol NO和1molO2混合发生反应2NO+O2=2NO2,生成NO22mol,但2NO2
,质子数、中子数、电子数均为1。1molD2O电子数为10mol,重水的摩尔质量为20g/mol,20g重水物质的量为1mol,①正确;2Fe2++H2O2+2H+=2Fe3++2H2O,1molFe2+失电子数为1mol,②错误;2mol NO和1molO2混合发生反应2NO+O2=2NO2,生成NO22mol,但2NO2 N2O4,所以体系中气体物质的量在1~2mol之间,③错误;二氧化硅晶体中,1个硅原子与4个氧原子相连,1个氧原子与2个硅原子相连,1molSiO2晶体中有4molSi-O键,④正确;2mol·L-1碳酸钠溶液中Na+的物质的量浓度为4mol/L,⑤错误;氯气与水反应是可逆反应,由题给条件无法计算出氢离子数目,⑥错误;1mol氮分子中共价键数为3mol,共用电子对数为3mol,22.4氮气不一定是1mol,⑦错误。NA
N2O4,所以体系中气体物质的量在1~2mol之间,③错误;二氧化硅晶体中,1个硅原子与4个氧原子相连,1个氧原子与2个硅原子相连,1molSiO2晶体中有4molSi-O键,④正确;2mol·L-1碳酸钠溶液中Na+的物质的量浓度为4mol/L,⑤错误;氯气与水反应是可逆反应,由题给条件无法计算出氢离子数目,⑥错误;1mol氮分子中共价键数为3mol,共用电子对数为3mol,22.4氮气不一定是1mol,⑦错误。NA
点评:本题结合可逆反应、氧化还原反应、物质的状态、物质结构等考查阿伏伽德罗常数知识。
本题难度:一般
2、选择题 标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为c?moL/L,则下列关系中不正确的是(溶质用NH3表示)( )
A.ρ=
B.ω=
C.c=
D.ω=
参考答案:A.ρ=mV=VL22.4L/mol×17g/molVL22.4L/mol×17g/mol+1000gρg/ml=17Vρ17V+22400g/ml,故A错误;
B.ω=溶质的质量溶液的质量×100%=VL22.4L/mol×17g/molVL22.4L/mol×17g/mol+1000g×100%=17V17V+22400,故B正确;
C.c=nV=VL22.4L/molVL22.4L/mol×17g/mol+1000gρ×10-3g/L=1000ρV17V+22400mol/L,故C正确;
D.ω═溶质的质量溶液的质量×100%=17g/mol×VL×cmol/LVL×1000×ρ/L=17c1000ρ,故D正确.
故选A.
本题解析:
本题难度:简单
3、计算题 取1.43g Na2CO3·10H2O溶于水配成100ml溶液,求:
(1)Na2CO3物质的量浓度
(2)Na+ 物质的量浓度
(3)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.004mol/L,求加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)
参考答案:(1)0.05mol/l
(2)0.1mol/L
(3)5mL
本题解析:
本题难度:一般
4、选择题 现用胆矾(CuSO4?5H2O)配制0.1mol/L的硫酸铜溶液,下列操作中合理的是( )
A.称量时,将胆矾晶体直接放在托盘天平的右盘上
B.准确称取16.0g胆矾,在1000mL容量瓶中溶解,定容
C.准确称取25.0g胆矾,溶于水,所得溶液恢复到室温,再转移至1000mL容量瓶中,洗涤并转移,定容
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
参考答案:A、使用托盘天平时将药品放在左盘,砝码放在右盘,并垫质量、大小相等的纸片,故A错误;
B、不能在容量瓶内溶解药品或稀释溶液,产生热效应影响溶液浓度,故B错误;
C、配制1000mL0.1mol/L的硫酸铜溶液需胆矾的质量为1L×0.1mol/L×250g/mol=25.0g,溶于水,将所得溶液恢复到室温,再转移至1000mL容量瓶中,洗涤并转移,定容,可得0.1mol/L的硫酸铜溶液,故C正确;
D、定容后经振荡、摇匀、静置,发现液面低于刻度线,少量溶液残留在瓶塞与瓶口之间,再加蒸馏水补至刻度线,导致所配溶液的体积偏大,溶液的浓度偏低,故D错误;
故选C.
本题解析:
本题难度:一般
5、选择题 设阿伏加德罗常数为NA,标准状况下,mg N2和O2的混合气体含有b个分子,则ng该混合气体在相同状态下的体积为(单位为L)(? )
A.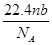
B.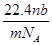
C.
D.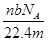
参考答案:B
本题解析:mg混合气体的物质的量为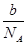 mol,所以ng该混合气体的物质的量为
mol,所以ng该混合气体的物质的量为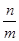 ×
×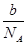 mol,标准状况下的该气体体积为
mol,标准状况下的该气体体积为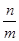 ×
×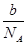 mol×22.4 L/mol=
mol×22.4 L/mol=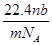 L。
L。
本题难度:一般