微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 有一纯净的亚硫酸钠晶体因部分被氧化而变质,为了测定样品中杂质的质量分数进行以下实验过程,按要求填写空格:
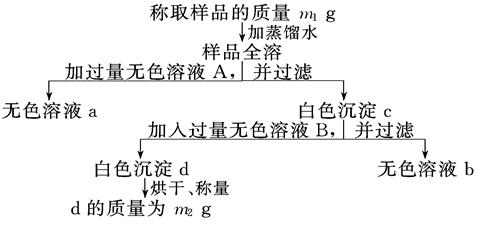
(1)向混合溶液中加入的无色溶液A是____________(填化学式),A必须过量的原因是
________________________________________________________________________.
(2)白色沉淀c中含有____________________(填化学式).
(3)无色溶液B通常是_____________(填试剂名称),加入后与c反应的离子方程式为
________________________________________________________________________.
(4)通过以上测定可得到样品中杂质的质量分数的计算式为_______________________.
参考答案:(8分)(1)BaCl2(1分)使SO32-、SO42-沉淀完全(1分)(2)BaSO4、BaSO3(1分)
(3)稀盐酸(1分)2H++BaSO3=H2O+SO2↑+Ba2+(2分)(4)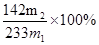 (2分)
(2分)
本题解析:(1)不论是亚硫酸钠,还是硫酸钠,都能和氯化钡溶液反应生成白色沉淀,据此可以检验和计算,所以A是氯化钡。氯化钡过量的目的是使使SO32-、SO42-沉淀完全。
(2)根据(1)中分析可知,白色沉淀c中含有BaSO4、BaSO3。
(3)要溶解亚硫酸钡,而又不能影响硫酸钡,则B应该是盐酸,不能用硝酸,因为硝酸具有氧化性,反应的方程式是2H++BaSO3=H2O+SO2↑+Ba2+。
(4)最终得到的白色沉淀d是硫酸钡,质量是m2g,则该原子守恒可知,样品中杂质的质量分数的计算式为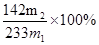 。
。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,难易适中,基础性强。在注重对学生基础知识巩固和训练的同时,侧重对学生实验能力的培养。有利于调动学生的学习兴趣,激发学生的学习积极性,也有利于培养学生的逻辑推理能力和规范严谨的实验设计能力和动手操作能力,提升学生的学科素养。
本题难度:一般
2、填空题 (8分)在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
(1)生成的黑色物质是?(填化学式)。
(2)刺激性气味的气体主要成分是?(填化学式),产生该气体的化学方程式为?。
(3)根据上述实验现象,表明浓硫酸具有?(填序号)。
①酸性?②吸水性?③脱水性?④强氧化性
参考答案:(1)c? (2)SO2?
C + 2H2SO4(浓) =加热= CO2 ↑+ 2SO2↑+ 2H2O
(3) ?③?④
本题解析:略
本题难度:一般
3、选择题 右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。

据此下列说法正确的是
A.该试剂的物质的量浓度为9.2 mol·L—1
B.该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L
C.配制200 mL 4.6 mol·L—1的稀硫酸需取该硫酸50 mL
D.该硫酸与等体积的水混合所得溶液的质量分数小于49%
参考答案:C
本题解析:A错,该试剂的物质的量浓度为18.4 mol·L—1;B错,浓硫酸与铜反应随反应的不断进行,浓硫酸会变成稀硫酸,稀硫酸与铜不反应;C正确;D错,该硫酸与等体积的水混合所得溶液的质量分数大于49%
本题难度:一般
4、计算题 将SO2和O2以体积比为1:3混合后,通入接触室发生反应2SO2(g)+O2(g) 2SO3(g),达平衡时,在同温、同压下测得反应前与反应后混合气体的密度之比为71:80。求SO2的转化率?并回答SO2接触氧化为SO3时不采取加压措施的原因。
2SO3(g),达平衡时,在同温、同压下测得反应前与反应后混合气体的密度之比为71:80。求SO2的转化率?并回答SO2接触氧化为SO3时不采取加压措施的原因。
参考答案:90%?在工业上不加压,SO2的转化率就达90% 以上,已经很高,若再加压SO2的转化率提高不大,但对设备的要求要提高许多,故没有必要再加压。
本题解析:这是一道关于化学平衡和转化率的综合计算题。根据相同条件下气体的密度之比等于同体积气体的质量之比,且反应前后质量守恒,可得出气体的密度之比等于气体体积的反比。设反应前混 合气体中SO2的体积为1 L,O2应为3 L达平衡时SO2的转化的体积为x 。
2SO2(g)+O2(g) ≒?2?SO3(g)?总体积
V/L(起始)? 1? 3? 0? 4L
V/L(转化)? 2x? x?2x
V/ L(平衡)1-2x? 3-x? 2x? 4-x
根据气体的密度之比等于气体体积的反比,可得:
71:80=(4-x):4? x=0.45L,则转化的二氧化硫为0.9L,
二氧化硫的转化率为:0.9L÷1L×100%=90%
在工业上不加压,SO2的转化率就达90% 以上,已经很高,若再加压SO2的转化率提高不大,但对设备的要求要提高许多,故没有必要再加压。
本题难度:一般
5、选择题 向盐酸中加入浓H2SO4时,会有白雾生成。下列叙述不属于导致产生该现象的原因的是…( )
A.浓H2SO4具有脱水性
B.浓H2SO4具有吸水性
C.盐酸具有挥发性
D.气体溶质的溶解度随温度升高而降低
参考答案:A
本题解析:浓硫酸的脱水性是指浓硫酸把有机物的H、O两元素按原子个数比2:1的比例脱出来,形成水分子。而吸水性是指吸收现成的水分子,包括水蒸汽、湿存水和结晶水
本题难度:简单