微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述中错误的是
A.将SO2气体通入足量的Ba(OH)2溶液中有白色沉淀生成
B.将SO2气体通入BaCl2溶液中有白色沉淀生成
C.将SO2气体通入用硝酸酸化的BaCl2溶液中有白色沉淀生成
D.将HNO3酸化后的BaCl2溶液加入含某种离子的溶液中有白色沉淀生成,不能判断该溶液中一定存在SO42-
参考答案:B
本题解析:略
本题难度:简单
2、选择题 SCl2熔点为—78℃,沸点为59℃。若0.2mol SCln与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀。下列判断错误的是
A.n =" 2"
B.SCln中每个原子最外层均满足8电子稳定结构
C.SCln在固态时为分子晶体
D.SCln溶于水能电离出Cl--
参考答案:D
本题解析:略
本题难度:一般
3、实验题 (17分)I.为探究SO2的性质,需要标准状况下11.2 LSO2气体。化学小组同学依据化学方程式Zn+ 2H2SO4(浓)=ZnSO4+SO2↑+2H2O计算后,取32.5g锌粒与质量分数为98%的浓硫酸(密度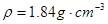 )? 60mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
)? 60mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是?(填分子式)。产生这种结果的主要原因是?(用化学方程式和必要的文字加以说明)
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。
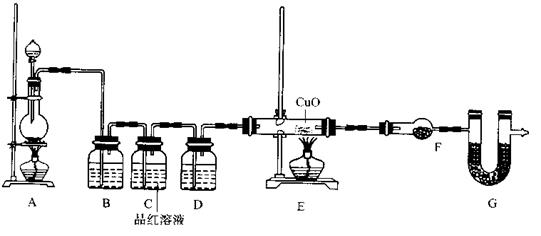
①置B中加入的试剂?,装置C中品红溶液的作用是?。
②装置D加入的试剂?,装置F加入的试剂?。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是?。
④U型管G加入的试剂?,作用为?.
II.工业上可采用电化学法利用H2S废气制取氢气,该法制氢过程的示意图所示,回答下列问题:
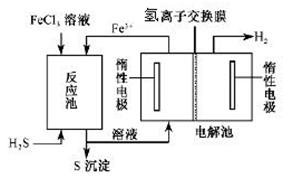
(1)产生反应池中发生反应的化学方程式为 ?。
(2)反应后的溶液进入电解池,电解时阳极反应式为?。
(3)若电解池中生成5. 6 L H2(标准状况),则理论上在反应池中可生成S沉淀的物质的量为___________ mol。
参考答案:I.(1)H2(1分);随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2,
Zn+H2SO4===ZnSO4+H2↑(2分)
(2)①NaOH溶液(或KMnO4,其它合理答案也给分,1分)
证明SO2已被完全除尽。(1分)
②浓硫酸(1分)?无水硫酸铜(1分)
③装置E中玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色(2分)
④碱石灰(1分)防止空气中H2O进入干燥管而影响杂质气体的检验(1分)
II.?(1)H2S + 2FeCl3 = 2FeCl2 + S↓ + 2HCl(2分)
(2)2Fe2+ — 2e- ?2Fe3+ (2分)?
?2Fe3+ (2分)?
(3)0.25(2分)
本题解析:I.(1)Zn的物质的量为0.5mol,浓硫酸中含H2SO4为1.84g/mL×60mL×98%÷98g/mol="1.1mol," 随着反应的进行,硫酸浓度降低,当硫酸变为稀硫酸时,发生反应:Zn+H2SO4===ZnSO4+H2↑,所以化学小组所制得的气体中混有的主要杂质气体可能是H2。
(2)①为了防止SO2对H2检验的干扰,装置B中应加入吸收SO2的试剂,NaOH溶液或KMnO4溶液等;装置C中品红溶液的作用是证明SO2已被完全除尽。
②H2还原CuO生成H2O,为了避免原气体中水分的干扰,装置D加入的试剂为浓硫酸;F的作用是检验气体与CuO反应生成了H2O,所以加入的试剂为无水硫酸铜。
③H2还原CuO的实验现象是:装置E中玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色。
④为防止外界空气中H2O进入干燥管而影响杂质气体氢气的检验,装置G中应加入碱石灰。
II. (1)根据示意图,反应池加入的FeCl3与H2S为反应物,生成了S,发生了氧化还原反应,所以化学方程式为:H2S + 2FeCl3 = 2FeCl2 + S↓ + 2HCl
(2)反应后的溶液FeCl2和HCl进入溶液,生成H2的电极为阴极,所以阳极上失去电子的离子为Fe2+,所以阳极反应式为:2Fe2+ — 2e- ?2Fe3+
?2Fe3+
(3)根据电解池中电子守恒和反应池的化学方程式可得关系式:S ~ 2Fe2+ ~ H2,所以n(S)=n(H2)=5.6L÷22.4L/mol=0.25mol。
本题难度:一般
4、选择题 常温下,可用铁或铝制容器盛装冷的浓硫酸,是因为其发生了钝化,这表现浓硫酸的(?)
A.吸水性
B.脱水性
C.强氧化性
D.酸性
参考答案:C
本题解析:浓硫酸具有强氧化性,常温下能使铁、铝等金属钝化,生成氧化膜,阻止反应的继续进行:
4Al+12HNO3(浓)=2Al2O3+12NO2↑+6H2O
4Fe+12HNO3(浓)=2Fe2O3+12NO2↑+6H2O
点评:本题考查浓硫酸的性质,弄清钝化的原理是解答本题的关键。
本题难度:一般
5、计算题 某化学小组为了测定石膏(CaSO4·xH2O)的组成,即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如右图所示。数据表明当固体的质量为2.72 g后不再改变。求(必须写出计算过程):
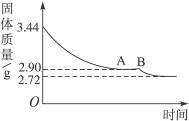
(1)石膏的化学式。
(2)图象中AB段对应化合物的化学式。
参考答案:(1)CaSO4·2H2O
(2)2CaSO4·H2O或CaSO4·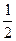 H2O
H2O
本题解析:CaSO4·xH2O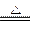 CaSO4+xH2O
CaSO4+xH2O
136+18x? 136? 18x
3.44 g? 2.72 g? 0.72 g
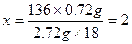
该化合物化学式为CaSO4·2H2O。
(2)实验数据和图象AB段说明在石膏受热分解过程中,有一固定组成的化合物存在。
CaSO4·2H2O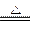 CaSO4·yH2O+(2-y)H2O
CaSO4·yH2O+(2-y)H2O
172? 136+18y
3.44 g? 2.90 g
解得y=0.5
该化合物化学式为2CaCO4·H2O(或CaSO4·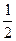 H2O)。
H2O)。
本题难度:简单